H2 und HHO bei Krebs
Ein Review aus Japan aus dem Jahre 2021
Das neue Review gibt uns mehr Einblicke in die Wirksamkeit von H2 und HHO bei der Tumorbekämpfung
Molekularer Wasserstoff als neuartiges Antitumormittel:
Mögliche Mechanismen, die der Genexpression zugrunde liegen
Shin-ichi Hirano 1,* , Haru Yamamoto 2,3, Yusuke Ichikawa 1,2, Bunpei Sato 1,2, Yoshiyasu Takefuji 4,5 and Fumitake Satoh 1
Department of Research and Development, MiZ Company Limited, 2-19-15 Ofuna, Kamakura 247-0056, Kanagawa, Japan; y_ichikawa@e-miz.co.jp (Y.I.); b_sato@e-miz.co.jp (B.S.); info@e-miz.co.jp (F.S.)
2 MiZ Inc., 39899 Balentine Drive Suite 200, Newark, CA 94560, USA; haru.yamamoto@berkeley.edu
3 Department of Molecular & Cell Biology, University of California, Berkeley, 3060 Valley Life Sciences Bldg #3140, Berkeley, CA 94720-3140, USA
4 Faculty of Environment and Information Studies, Keio University (Professor Emeritus), 5322 Endo,
Fujisawa 252-0882, Japan; takefuji@keio.jp
5 Faculty of Data Science, Musashino University, 3-3-3 Ariake, Koto-Ku, Tokyo 134-8181, Japan
* Correspondence: s_hirano@e-miz.co.jp; Tel.: +81-467-53-7511
Copyright: © 2021 by the authors. Licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution (CC BY) license (https:// creativecommons.org/licenses/by/ 4.0/).
Während viele Antitumormedikamente zu unbefriedigenden therapeutischen Ergebnissen geführt haben, sind Medikamente eine der am weitesten verbreiteten therapeutischen Maßnahmen zur Behandlung von Krebserkrankungen. Die Entstehung von Krebs resultiert größtenteils aus Mutationen in der Kern-DNA sowie in der mitochondrialen DNA(mtDNA).
Molekularer Wasserstoff (H2), ein inertes Molekül, kann Hydroxylradikale (OH) abfangen, von denen bekannt ist, dass sie die stärksten oxidierenden reaktiven Sauerstoffspezies (ROS) im Körper sind, die diese DNA-Mutationen verursachen. Es wurde berichtet, dass H2 im Gegensatz zu herkömmlichen Antitumormedikamenten keine Nebenwirkungen hat und dass es gegen viele Krankheiten wirksam ist, die durch oxidativen Stress und chronische Entzündungen verursacht werden.
In jüngster Zeit gibt es eine zunehmende Anzahl von Arbeiten über die Wirksamkeit von H2 gegen Krebs und seine Auswirkungen auf die Abschwächung der Nebenwirkungen von Krebsbehandlungen. In dieser Übersichtsarbeit zeigen wir die Wirksamkeit und Sicherheit von H2 als neuartigen Antitumorwirkstoff und zeigen, dass seine Mechanismen nicht nur das direkte Abfangen von OH beinhalten können, sondern auch andere indirekte biologische Abwehrmechanismen über die Regulation der Genexpression.
Schlüsselwörter: molekularer Wasserstoff; Antitumor-Wirkung; Genexpression; ROS; reaktive Sauerstoffspezies;
DNA-Mutation; oxidativer Stress; Antitumormittel; Klinische Anwendung
1. Einleitung
Tumore wachsen autonom, gegen die Kontrolle des Organismus, und können in bösartige und gutartige Tumore eingeteilt werden. Bösartige Tumoren sind durch autonomes Wachstum, Invasion, Metastasierung und Kachexie gekennzeichnet [1]. Gutartige Tumore wachsen autonom, sind aber nicht mit Invasion, Metastasierung und Kachexie verbunden. Bösartige Tumoren werden grob nach dem Organ oder Gewebe klassifiziert, in dem sie entstehen: Karzinome aus Epithelzellen, Sarkome aus Nicht-Epithelzellen, hämatopoetische Malignome aus hämatopoetischen Organen und Mesotheliome aus Mesothelzellen [1].
Laut einer Statistik der Internationalen Agentur für Krebsforschung (IARC), einer externen Forschungsorganisation der Weltgesundheitsorganisation (WHO), gab es im Jahr 2020 weltweit etwa 19 Millionen Krebsfälle und 10 Millionen Krebstodesfälle [2]. Anders ausgedrückt: Ein Drittel aller Männer und ein Viertel aller Frauen erkranken im Laufe ihres Lebens an irgendeiner Form von Krebs, wobei es zwischen verschiedenen Ländern und Regionen leichte Unterschiede gibt [2]. Die drei wichtigsten Behandlungsmethoden für Krebs sind traditionell Operation, Strahlentherapie und medikamentöse Therapie. In der medikamentösen Therapie werden häufig zytotoxische Krebsmedikamente wie Platinmedikamente, Antitumorantibiotika, Alkylierungsmittel, Antimetaboliten und Topoisomerase-Inhibitoren sowie molekulare Zielmedikamente wie Tyrosinkinase-Inhibitoren und Antikörper-Medikamente eingesetzt [3,4]. Darüber hinaus wurden in jüngerer Zeit auch Nukleinsäuremedikamente eingesetzt, wie Antisense und small interfering RNA (siRNA) und Immun-Checkpoint-Inhibitoren wie Anti-programmierter Zelltod 1 (PD-1), Anti-Antikörper gegen programmierten Zelltod-Liganden 1 (PD-L1) und Antikörper gegen antizytotoxische T-Lymphozyten-assoziierte Proteine 4 (CTLA-4) eingesetzt [5,6]. Keines dieser Medikamente hat jedoch zu zufriedenstellenden therapeutischen Ergebnissen geführt [7]. Mit der Entwicklung der modernen Medizin haben sich diagnostische Techniken und therapeutische Maßnahmen bei Krebs weiterentwickelt, und die relative Überlebensrate bei Krebs hat sich von Jahr zu Jahr verbessert [2].
Dennoch bleibt es eine der wichtigsten Krankheiten, die der Mensch überwinden muss. Molekularer Wasserstoff (H2) ist ein brennbares, farbloses, geruchloses und ungiftiges Gas. Im Jahr 1975 berichteten Dole et al. erstmals über die potenziellen medizinischen Anwendungen von H2 [8]. Sie zeigten, dass eine hyperbare Behandlung durch die Inhalation von 2,5 % Sauerstoff und 97,5 % H2-Gas das Plattenepithelkarzinom bei Mäusen, die mit ultravioletter (UV) Bestrahlung induziert wurden, signifikant zurückbildete. Im Jahr 2007 zeigten Ohsawa et al., dass die Inhalation von H2-Gas (1–4%) die zerebrale Ischämie-Reperfusionsschädigung in einem Rattenschlagmodell signifikant verbesserte [9]. Sie fanden heraus, dass die Mechanismen von H2 gegen Hirninfarkte das selektive Abfangen von Hydroxylradikalen (OH) und Peroxynitrit (ONOO, bei denen es sich um oxidative reaktive Sauerstoffspezies (ROS) bzw. reaktive Stickstoffspezies (RNS) handelt [9]. Diese Arbeit von Ohsawa et al. führte zu weltweiten Forschungen über die medizinischen Anwendungen von H2; Yanagihara et al. zeigten auch schon im Jahr 2005, zwei Jahre vor den Berichten von Ohsawa et al., dass die orale Verabreichung von neutralem elektrolysiertem Wasser (1,6 ppm), das durch Elektrolyse produziertes H2 enthielt, bei Ratten oxidative Schäden in der Leber, die durch chemische Oxidationsmittel induziert wurden, signifikant verbesserte [10].
Diese Arbeit kann als die bahnbrechende Studie angesehen werden, die die potenziellen medizinischen Anwendungen von H2 motiviert. Die Erforschung der medizinischen Anwendungen von H2 hat rasante Fortschritte gemacht. Im Gegensatz zu herkömmlichen Medikamenten hat H2 keine Nebenwirkungen und ist wirksam bei der Behandlung vieler Krankheiten, die durch oxidativen Stress und chronische Entzündungen verursacht werden [11–13]. In einer kürzlich veröffentlichten Arbeit berichteten wir, dass H2 das einzige Molekül ist, das in der Lage ist, mitochondriale Translokation mit OH-Fängerfähigkeit zu betreiben [14]. H2 hat klinische Vorteile für viele Krankheiten, darunter neurologische Erkrankungen [15–17], Herz-Kreislauf-Erkrankungen [18,19], Atemwegserkrankungen [20,21], Diabetes [22], Leber und metabolisches Syndrom [23,24]. In jüngster Zeit haben viele Studien zu H2 über seine Wirksamkeit gegen Krebs und seine Aktivität bei der Verbesserung der Nebenwirkungen von Krebsbehandlungen berichtet [25–46].
Es gibt jedoch keine Übersichtsarbeiten, die das Potenzial von H2 als neuartiger Antitumorwirkstoff detailliert beschreiben und seine klinischen Anwendungen mit den möglichen Mechanismen analysieren. Andererseits wurde mit den jüngsten Entwicklungen in der Molekularbiologie von Krebs die Rolle von ROS bei Krebs in molekulargenetischen Studien aufgeklärt. In dieser Arbeit untersuchen wir die Wirksamkeit von H2 als neuartiges Antitumormittel und die zugrunde liegenden Mechanismen aus Sicht der Genexpression. Darüber hinaus zeigen wir die Perspektiven von H2 als neuartigen Antitumorwirkstoff in der klinischen Anwendung.
2. Molekularbiologie von Krebs
Der menschliche Körper besteht aus etwa 37 Billionen Zellen; Jeden Tag sterben etwa 1 Billion Zellen ab und 1 Billion neue Zellen werden geboren [1]. Diese Zellen werden auf der Grundlage der genetischen Information in der genomischen DNA erzeugt, aber verschiedene Faktoren können Mutationen in diesen Genen verursachen, die zur Entwicklung von Tumoren in normalen Zellen führen [1]. Selbst bei einem gesunden Menschen werden täglich Tausende von Krebszellen im Körper produziert. Genetische Mutationen können durch eine Vielzahl von Substanzen induziert werden, darunter Bakterien, Viren, Parasiten, chemische Substanzen, ROS, ionisierende Strahlung und UV-Licht [1].
Nicht alle mutierten Zellen werden zu Krebszellen, da sich diese Mutationen durch einen mehrstufigen Prozess (mehrstufige Karzinogenese) zu Krebs entwickeln [47]. Der menschliche Körper verfügt über einen Apoptose-Mechanismus, der die Zellteilung vorübergehend stoppt, nach Kopierfehlern in seinen Genen sucht, versucht, diese Fehler zu reparieren, und sich selbst tötet, wenn er nicht repariert werden kann [47]. Es gibt auch zwei Arten von Onkogenen, die Krebszellen sowohl fördern als auch unterdrücken: Das p53-Gen wird aktiviert, wenn Zellen oxidativem Stress ausgesetzt sind [48]. Das p53-Gen fungiert als transkriptioneller Aktivator und spielt eine wichtige Rolle beim Zellzyklusarrest, der Reparatur genomischer DNA, der Induktion der Apoptose, der Hemmung der Metastasierung von Krebszellen und der Angiogenese [48]. Aus diesem Grund wurde das p53-Gen als "Wächter des Genoms" bezeichnet [49]. Wenn jedoch das normalerweise aktive p53-Gen inaktiviert wird, wird nicht nur die Zellteilung nicht gestoppt, sondern abnorme Zellen durchlaufen keine Apoptose und Krebszellen wachsen weiter, nachdem sie sich entwickelt haben [48,49]. Mutationen oder Deletionen im p53-Gen finden sich bei mehr als der Hälfte der menschlichen Krebserkrankungen [50]. Wenn das p53-Gen durch Methylierung (eine epigenetische Veränderung) inaktiviert wird, verwandeln sich normale Zellen in Krebszellen [50]. Wenn das körpereigene Immunsystem jedoch aufgrund von Alterung oder schlechten Lebensstilentscheidungen geschwächt ist, ist das Immunsystem möglicherweise nicht in der Lage, Krebszellen zu eliminieren, und so können sie sich weiter vermehren. Wenn Krebszellen eine sichtbare Größe von 0,5 bis 1 cm erreichen, spricht man von Krebs [1].
3. Redoxkontrolle bei Krebs
Ein erwachsener Mensch nimmt etwa 430 l Sauerstoff pro Tag über die Atmung auf. Allerdings werden 2–3 % der ROS während dieses Prozesses vom Körper produziert [11–13]. Normalerweise halten sich die Produktion von ROS und seine Spülsysteme die Waage; Die übermäßige Produktion von ROS aufgrund von Rauchen, Alkoholkonsum, Luftverschmutzung, UV-Licht, Bestrahlung, anstrengender körperlicher Betätigung sowie physischem und psychischem Stress kann jedoch oxidativen Stress hervorrufen, der zu einer Vielzahl schädlicher Auswirkungen auf den Körper führt [11–13]. Im menschlichen Körper gibt es vier eng definierte ROS: Superoxid-Anionen (O2
Wasserstoffperoxid (H2O2), Singulettsauerstoff (1O2) und OH [12]. Der Hauptort für die Produktion von ROS in der Zelle sind die Mitochondrien. Sauerstoff, der aus dem mitochondrialen Elektronentransfersystem austritt, wird reduziert, um O2 zu produzieren, das dann durch Superoxiddismutase (SOD) in H2O2 und dann durch Enzyme wie Katalase in Wasser umgewandelt wird [11,12]. OH entsteht, wenn Wassermoleküle mit ionisierender Strahlung bestrahlt werden oder wenn H2O2 mit UV-Licht bestrahlt wird. Bei einem Eisenüberschuss in der Nähe von H2O2 kommt es zu einer Fenton-Reaktion, bei der zweiwertige Eisenionen mit H2O2 zu OH reagieren (Abbildung 1) [11,12]. Von diesen ROS ist OH etwa 100-mal potenter als O2 und ist in der Lage, sowohl Kern-DNA als auch mtDNA direkt zu oxidieren, aber H2 kann große Mengen an OH, die in den Mitochondrien produziert werden, abfangen, indem es es in Wassermoleküle umwandelt [11–13].
aktiviert, wenn Zellen oxidativem Stress ausgesetzt sind [48]. Das p53-Gen fungiert als transkriptioneller Aktivator und spielt eine wichtige Rolle beim Zellzyklusarrest, der Reparatur genomischer DNA, der Induktion der Apoptose, der Hemmung der Metastasierung von Krebszellen und der Angiogenese [48]. Aus diesem Grund wurde das p53-Gen als "Wächter des Genoms" bezeichnet [49]. Wenn jedoch das normalerweise aktive p53-Gen inaktiviert wird, wird nicht nur die Zellteilung nicht gestoppt, sondern abnorme Zellen durchlaufen keine Apoptose und Krebszellen wachsen weiter, nachdem sie sich entwickelt haben [48,49].
Mutationen oder Deletionen im p53-Gen finden sich bei mehr als der Hälfte der menschlichen Krebserkrankungen [50]. Wenn das p53-Gen durch Methylierung (eine epigenetische Veränderung) inaktiviert wird, verwandeln sich normale Zellen in Krebszellen [50]. Wenn das Immunsystem des Körpers jedoch aufgrund von Alterung oder schlechten Lebensstilentscheidungen geschwächt ist, ist das Immunsystem möglicherweise nicht in der Lage, Krebszellen zu eliminieren, und so können sie sich weiter vermehren. Wenn Krebszellen eine sichtbare Größe von 0,5 bis 1 cm erreichen, spricht man von Krebs [1].
Der Hauptort für die Produktion von ROS in der Zelle sind die Mitochondrien. Sauerstoff, der aus dem mitochondrialen Elektronentransfersystem austritt, wird reduziert, um O2− zu produzieren, das dann durch Superoxiddismutase (SOD) in H2O2 und dann durch Enzyme wie Katalase in Wasser umgewandelt wird [11,12]. · OH entsteht, wenn Wassermoleküle mit ionisierender Strahlung bestrahlt werden oder wenn H2O2 mit UV-Licht bestrahlt wird. Bei einem Eisenüberschuss in der Nähe von H2O2 kommt es zu einer Fenton-Reaktion, bei der zweiwertige Eisenionen mit H2O2 zu ·
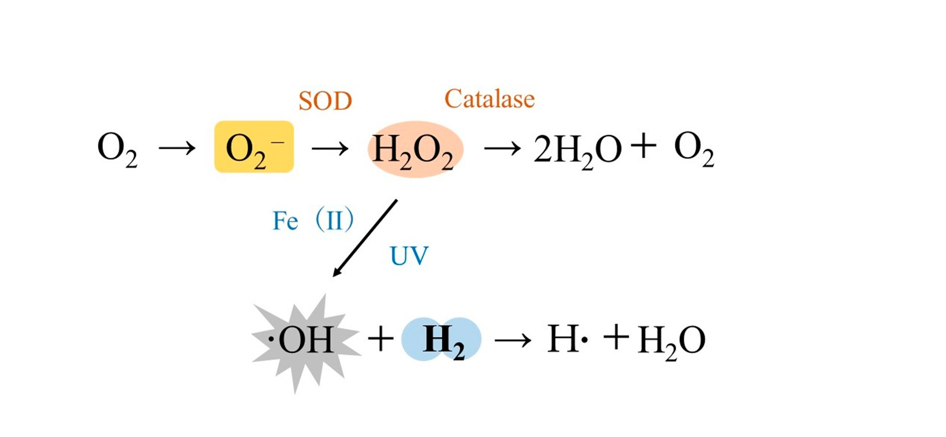
Figure 1. OH (Abbildung 1) [11,12]. Von diesen ROS, · OH ist etwa 100-mal stärker als O2− und ist in der Lage, sowohl Kern-DNA als auch mtDNA direkt zu oxidieren, aber H2 kann große Mengen an · OH, das in den Mitochondrien durch Umwandlung in Wassermoleküle produziert wird [11–
Frühere Studien haben gezeigt, dass die Hauptursache für Krebs Anomalien in der genomischen DNA sind [1]. Oxidativer Stress, der durch ROS verursacht wird, trägt zur genetischen Veränderung des karzinogenen Prozesses bei [1]. So zeigen viele Modelle der Karzinogenese einen erhöhten Spiegel von 8-Hydroxy-2t-desoxyguanidin (8-OHdG) in den Zielorganen zu Beginn des Prozesses [51]. 8- OHdG ist eine hydroxylierte Form von Desoxyguanosin (dG), einer der Basen der DNA.Da dG das niedrigste Redoxpotential unter den vier Basen der DANN hat , ist es anfällig für Oxidation durch ROS. 8-
OHdG ist eine von mehr als 100 DNA-modifizierenden Basen, die bei oxidativem Stress in den höchsten Mengen produziert werden [52]. 8-OHdG kann als Biomarker verwendet werden, um oxidativen Stress in vivo quantitativ widerzuspiegeln, da es chemisch stabil ist und ohne Sekundärstoffwechsel in Blut und Urin abgegeben wird [53, 54]. Oxidativer Stress wird auch mit Zellschäden und Krebsentstehung in Verbindung gebracht, die durch ionisierende Strahlung verursacht werden. In einer kürzlich durchgeführten Übersichtsarbeit konnten wir zeigen, dass die strahlenprotektive Wirkung von H2 nicht nur das direkte Abfangen von ·OH, sondern auch antioxidative, entzündungshemmende und anti-apoptotische Wirkungen über die Regulation der Genexpression [55].
Das Proteinprodukt des Tumorsuppressorgens p53 hemmt nicht nur die Entstehung und das Fortschreiten von Krebs, sondern reagiert auch auf verschiedene zelluläre Stressfaktoren wie Hypoxie, Virusinfektion, Stoffwechselstress, endoplasmatischen Retikulumstress und oxidativen Stress. p53 fungiert auch als Transkriptionsfaktor und zeigt Effekte wie Zellzyklusarrest, DNA-Reparatur, Unterdrückung der Angiogenese, Seneszenz-Induktion und Apoptose-Induktion. Da zellulärer Stress eine Ursache für Krebs ist, unterdrückt p53 die Entstehung und das Fortschreiten von Krebs durch diese Stressreaktionen [48,56]. Insbesondere der Mechanismus, durch den oxidativer Stress die Aktivierung des p53-Gens verursacht, ist bedeutsam, wenn man ihn als einen Mechanismus betrachtet, durch den der Körper die Homöostase aufrechterhält. Andererseits gibt es Berichte, dass p53 an verschiedenen Phänomenen des T-Zell-Lymphoms beteiligt ist, wie z.B. der DNA-Reparatur, der Aufrechterhaltung mitochondrialer Proteine und der Regulation der Ribosomenbiogenese, und zwar durch andere Funktionen als die Stressantwort, d.h. Funktionen, die keine Transkrippingfaktoren beinhalten [57]. Die Methylierung des p53-Gens ist einer der Hauptmechanismen für die Inaktivierung des p53-Gens und ist eine typische epigenetische Veränderung, die durch DNA-Methyltransferasen (DNMT) induziert wird [58]. Derzeit wird Azacitidin, ein führender Inhibitor der DNA-Methylierung, für myelodysplastische Syndrome (MDS) klinisch untersucht [59].
Der Zusammenhang zwischen Krebs, chronischen Entzündungen und Alterung
Die Entzündung ist ein Gewebereparaturmechanismus, der die Homöostase als Reaktion auf Infektionen und Gewebeschäden aufrechterhält [60]. Eine akute Entzündung ist vorübergehend und reversibel, während eine chronische Entzündung induziert wird, wenn die Entzündung durch eine Störung verzögert wird [60]. Aktuelle epidemiologische Erkenntnisse deuten darauf hin, dass bis zu 25% aller Krebserkrankungen mit chronischen Infektionen und chronischen Entzündungen assoziiert sind [61]. Chronische Entzündung und oxidativer Stress sind eng miteinander verbunden, und Mitochondrien-spezifische Radikalfänger können zur Kontrolle chronischer Entzündungen eingesetzt werden. In einer kürzlich durchgeführten Überprüfung haben wir gezeigt, dass ·OH, das in den Mitochondrien erzeugt wird, oxidativen Stress in der mitochondrialen DNA (mtDNA) induziert und dass diese oxidierte mtDNA die Aktivierung der Nukleotidbindungs- und Oligomerisierungsdomänen-ähnlichen Rezeptorfamilie Pyrin Domain induziert, die 3 (NLRP3) Inflammasom enthält [60]. Da die NLRP3-Aktivierung eine Kaskade von Ereignissen auslöst, die zur Freisetzung von pro-inflammatorischen Zytokinen wie Interleukin (IL)-1β und IL-18 führen, schlugen wir vor, dass der Mechanismus, durch den H2 chronisch entzündliche Erkrankungen lindert, zum Teil das Abfangen von ·OH, das in Mitochondrien produziert wird [60]. Andererseits wurde die Beziehung zwischen Entzündung und Krebs als ein exogener Signalweg beschrieben, bei dem die Entzündung den Krebszellen vorausgeht, und als ein endogener Signalweg, bei dem Veränderungen in Krebszellen, wie z. B. Mutationen in Onkogenen, der Entzündung vorausgehen [62]. Der Zusammenhang zwischen Krebs und Entzündungen ist jedoch komplex und bedarf weiterer Forschung.
Das Altern lässt sich in zwei Kategorien einteilen: das chronologische Altern und die zelluläre Seneszenz. Zelluläre Seneszenz ist das Aufhören der Proliferation normaler Zellen aufgrund ihrer eingeschränkten Teilungsfähigkeit. Es wurde angenommen, dass dies durch die Verkürzung der Telomere, der terminalen Strukturen der Chromosomen, verursacht wird [63]. Neuere Studien haben jedoch gezeigt, dass zelluläre Seneszenz nicht nur durch Telomerverkürzung, sondern auch durch oxidativen Stress und die Aktivierung von Onkogenen verursacht wird, die schwere DNA-Schäden verursachen können [64]. Die zelluläre Seneszenz verursacht ein Phänomen, das als seneszenzassoziierte sekretorische Phänotypen (SASP) bekannt ist und Entzündungen und Karzinogenese über die Sekretion von entzündlichen Zytokinen, Chemokinen und extrazellulären matrixabbauenden Enzymen fördert [65]. Dies deutet darauf hin,
dass die Akkumulation zellulärer Seneszenz eine Rolle bei der Entstehung von chronischen Entzündungen und Krebs spielen könnte.
1. Antitumorale Wirkung von H2
Berichte über die antitumorale Wirkung von H2 lassen sich grob einordnen in Literatur, die seine Wirksamkeit in Zellen oder Tiermodellen untersucht, und solche, die seine klinische Wirksamkeit bei menschlichen Tumoren untersuchen (Tabellen 1 und 2) [25–46]. Erstere lassen sich kategorisieren in Untersuchungen mit kultivierten Krebszellen, Transplantationen tierspezifischer Tumorlinien (allogene Transplantate), Xenotransplantate humaner Tumorlinien bei immungeschwächten Tieren oder Tumore, die bei Tieren durch UV- oder ionisierende Bestrahlung induziert werden [25–36]. Es gibt auch Berichte von Tieren, die mit einer fettreichen Diät gefüttert wurden, um eine nichtalkoholische Steatohepatitis (NASH) zu induzieren und ihre Wirksamkeit beim Fortschreiten von Leberkrebs zu bewerten [37]. Da das Wachstum von Krebs mit einer Angiogenese einhergeht, wurde darüber hinaus auch über die Wirksamkeit kultivierter Zellen auf die Angiogenese berichtet [38]. Im Folgenden finden Sie eine Zusammenfassung
Tabelle 1: Zusammenfassung der Antitumorwirkung von molekularem Wasserstoff (H2) in Zellmodellen und Tiermodellen.
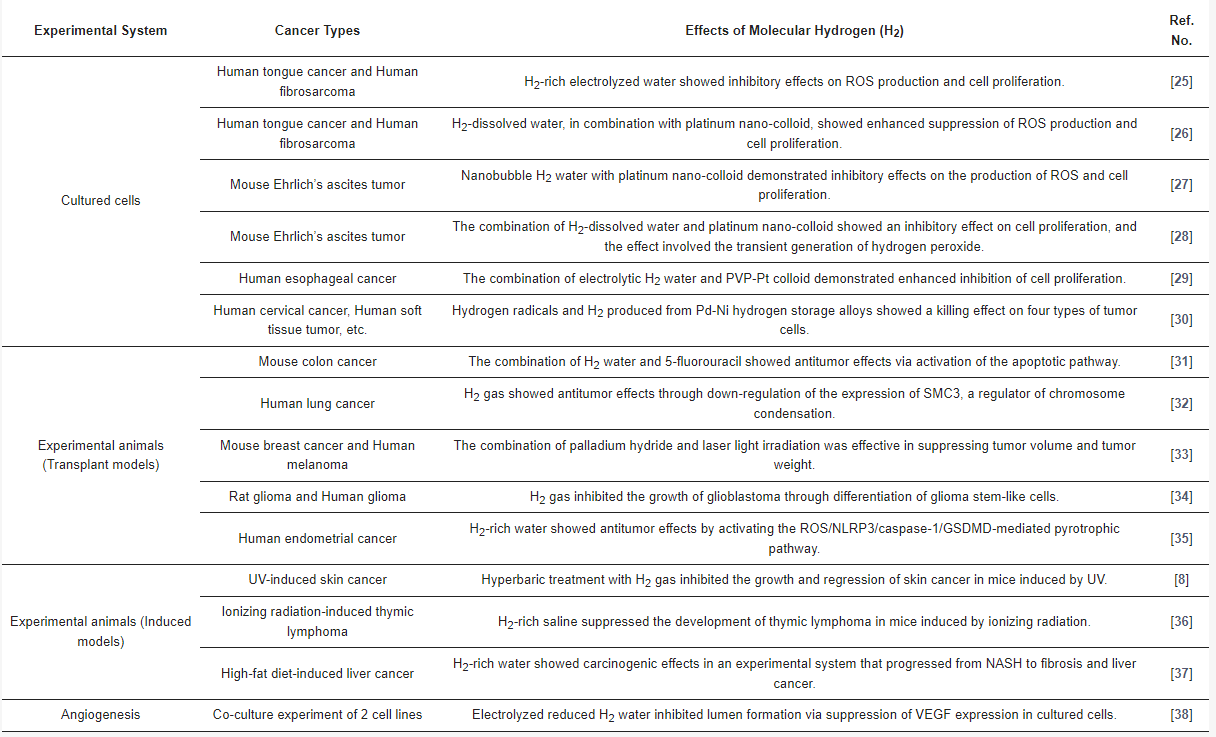
Bezeichnungen: H2: molekularer Wasserstoff; ROS: reaktive Sauerstoffspezies; PVP-Pt: Platin-Poly(N-vinylpyrrolidon); NLRP3: Pyrindomäne der Nukleotidbindungs- und Oligomerisierungsdomänen-ähnlichen Rezeptorfamilie mit 3; GSDMD: Gasdermin D; UV: Ultraviolett; NASH: nichtalkoholische Steatohepatitis; VEGF: vaskulärer endothelialer Wachstumsfaktor.
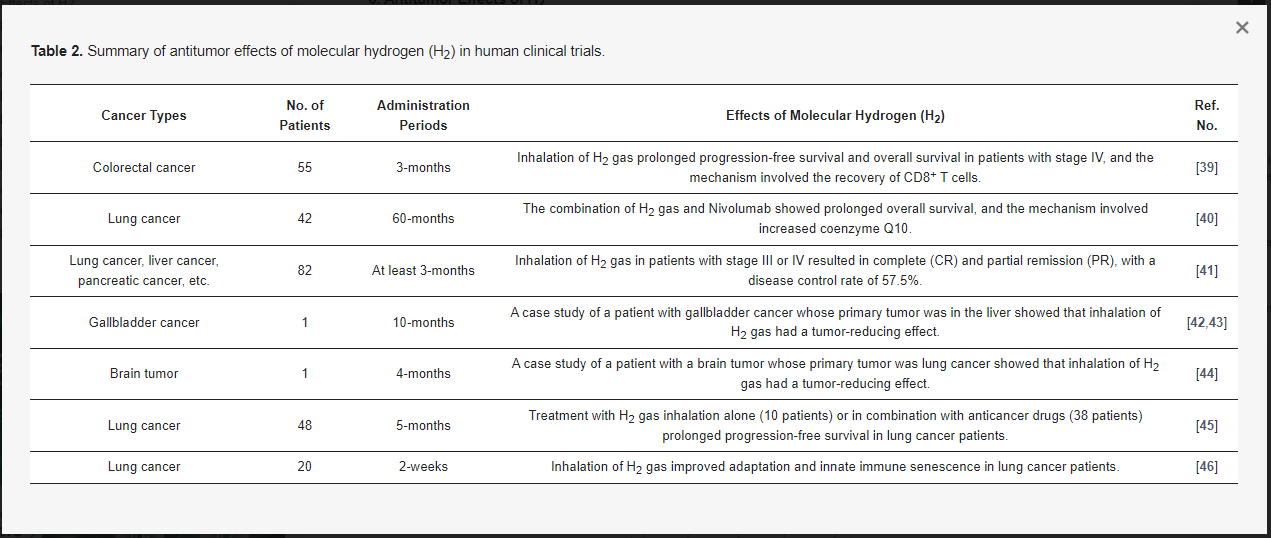
Tabelle 2. S Zusammenfassung der Antitumorwirkungen von molekularem Wasserstoff (H2) in klinischen Studien am Menschen.
1.1. Antitumoreffekte in Zell- oder Tiermodellen
1.1.1. Antitumoreffekte in zellulären Modellen
Saitoh et al. berichteten, dass neutrales wasserstoffreiches elektrolytisches Wasser (NHE-Wasser, 0,5–1,1 ppm) · in BSG in einem zellfreien System untersucht wurde [25]. Sie untersuchten auch die Auswirkungen von NHE-Wasser auf menschliche Zungenkarzinomzellen HSC-4 und normale menschliche Zungenepithel-ähnliche Zellen DOK [25]. Die Ergebnisse zeigten, dass NHE-Wasser die Koloniebildungsrate und die Koloniegröße von HSC-4-Zellen verringerte, aber nicht die von DOK-Zellen hemmte [25]. Bei humanen Fibrosarkomzellen HT-1080 hemmte NHE-Wasser die Proliferation, Zelldegeneration und das Eindringen aus rekonstituierten Basalmembranen. Darüber hinaus reduzierte NHE-Wasser die intrazelluläre Gesamt-ROS in HSC-4- und HT-1080-Zellen [25].
Saitoh et al. berichteten in einer weiteren Arbeit über die kombinierten Wirkungen von Platin-Nanokolloid (Pt-nc) und wasserstoffgelöstem Wasser (HD-Wasser, 1,0–1,3 ppm) auf HSC-4- und DOK-Zellen [26]. Die Kombination von HD-Wasser und Pt-nc verstärkte die Fängerwirkung von ROS unter Verwendung der DPPH-Radikalfängermethode (Diphenyl-Picrylhydrazyl). Darüber hinaus reduzierte die Kombination signifikant die Koloniebildungsrate und die Koloniegröße von HSC-4-Zellen im Vergleich zu HD-Wasser allein oder Pt-nc allein, während sie keine Kolonien von DOK-Zellen beeinflusste. Diese Ergebnisse deuten darauf hin, dass die verstärkte antioxidative Wirkung teilweise für den Mechanismus der verstärkten Hemmung des Zellwachstums bei der Kombination von HD-Wasser und Pt-nc verantwortlich sein könnte [26].
Asada et al. berichteten auch, dass die Anwendung von Nanobläschen-H2-Wasser (1,1–1,5 ppm) mit Platinkolloid in Ehrlichs Aszitestumorzellen (EAT) zu einer Hemmung der ROS-Produktion und Zellproliferation führte [27]. Dieser kombinierte Effekt war ausgeprägter als der von H2-Wasser allein oder Platinkolloid allein, gemessen an der Abnahme der Zellzahl, der Zellschrumpfung und der Apoptose [27]. Darüber hinaus wurde diese hemmende Wirkung auf die Zellproliferation in Kombination mit Hyperthermie bei 42 C verstärkt t, was darauf hindeutet, dass mit Platinkolloid angereichertes Nanobubble-H2-Wasser ein wirksames Antitumormittel sein könnte [27].
Saitoh et al. fanden auch heraus, dass die kombinierte Verwendung von HD-Wasser (1,0–1,5 ppm) und Pt-nc in EAT-Zellen eine hemmende Wirkung auf die Zellproliferation hatte, dieser Effekt jedoch in Gegenwart von Katalase signifikant abgeschwächt wurde [28]. Die Kombination induzierte auch Zellzyklusstörungen mit einer Abnahme des Anteils von G1-Phasenzellen und einer Zunahme von G2/M-Phasenzellen. Darüber hinaus waren die intrazellulären ROS-Spiegel unmittelbar nach der Behandlung mit H2 plus Pt-nc vorübergehend und signifikant erhöht, während dies nach der alleinigen Behandlung mit H2 oder Pt-nc nicht der Fall war. Basierend auf diesen Ergebnissen schlugen sie vor, dass die hemmende Wirkung der Kombination von HD-Wasser und Pt-nc auf die Zellproliferation die vorübergehende und signifikante Bildung von H2O2 beinhalten könnte [28].
Kato et al. berichteten, dass elektrolytisches H2-Wasser (0,6 ppm) in Kombination mit einem nanoskaligen Platin-Poly(N-vinyl-pyrrolidon)-Kolloid (PVP-Pt) die Wachstumshemmung menschlicher Ösophaguskrebszellen KYSE70 signifikant verbesserte [29]. Sie zeigten, dass die Koexistenz von 6-O-Palmitoylascorbat (Asc6Palm) und PVP-Pt in elektrolytischem H2-Wasser die veresterte Ascorbinsäure stabilisierte und die zelluläre Aufnahme von PVP-Pt erhöhte, was zu einer Hemmung der Zellproliferation führte [29].
Andererseits untersuchten Kagawa et al. die Auswirkungen von Pd-Ni-Wasserstoffspeicherlegierungen (HSA) auf kultivierte Krebszellen (HeLa, H1299, SW und DLD1) und normale Zellen (MDCK, GP8 und NIH3T3) [30]. Die Ergebnisse zeigten, dass HSA keine Wirkung auf normale Zellen hat, während es eine tödliche Wirkung auf Krebszellen in der Nähe ihrer Oberfläche hat. Aus diesen Ergebnissen schlossen sie, dass die auf der Oberfläche von HSA gebildeten Wasserstoffradikale charakteristische Veränderungen in Krebszellen verursachten und dass die Freisetzung von H2 für seine krebszellabtötende Wirkung verantwortlich sein könnte [30].
1.1.2. Antitumoreffekte im Tiermodell
Die antitumorale Wirkung von H2 wurde von Runtuwene et al. in vivo- und in-vitro-Studien mit Colon 26, einer aus Darmkrebs gewonnenen Zelllinie der Maus, berichtet [31]. H2-Wasser (0,25 oder 1,6 ppm) in Kombination mit 5-Fluorouracil (5-FU) wurde von den Mäusen oral aufgenommen. Die Kombination erhöhte die Überlebensrate von Mäusen im Vergleich zu H2-Wasser allein oder 5-FU allein [31]. H2-Wasser zeigte auch einen signifikanten ROS-Fängereffekt, und die Kombination verbesserte auch die Überlebensrate der kultivierten Zellen im Vergleich zu jeder einzelnen Zellen. Western-Blot-Analysen in kultivierten Zellen zeigten, dass die Kombination die Expression der phosphorylierten Adenosinmonophosphat-aktivierten Proteinkinase (p-AMPK), des Apoptose-induzierenden Faktors (AIF) und der Caspase-3 erhöhte, was darauf hindeutet, dass H2-Wasser durch die Aktivierung des apoptotischen Signalwegs antitumorale Eigenschaften hat [31].
Lungenkrebs ist eine der häufigsten und tödlichsten bösartigen Erkrankungen der Welt. Aufgrund seines hohen Metastasierungspotenzials und seiner Medikamentenresistenz hat Lungenkrebs eine schlechte Prognose für Patienten. Wang et al. untersuchten die wachstumshemmende Wirkung von H2-Gas (20–80%) auf die humanen Lungenkrebszelllinien A549 und H1975 und deren Mechanismen [32]. Sie untersuchten auch die antitumoralen Wirkungen und Mechanismen der Inhalation von H2-Gas (60%) für
2 h pro Tag bei Mäusen, die mit A549-Zellen xenotransplantiert wurden. Die Ergebnisse zeigten, dass H2-Gas in vitro konzentrationsabhängig die Zellproliferation hemmte und die Apoptose verstärkte und das Tumorwachstum in vivo signifikant hemmte [32]. Darüber hinaus unterdrückte H2-Gas die Expression von ROS und erhöhte die Expression von SOD, IL-1β, IL-8, IL-13 und Tumornekrosefaktor-α (TNF-α) im Lungengewebe. Immunhistochemische Färbungen von in vivo Experimenten bestätigten ebenfalls die Repression der SMC3-Expression durch H2. Wang et al. schlugen vor, dass H2 das Fortschreiten von Lungenkrebs durch die Herunterregulierung der Expression von SMC3, einem Regulator der Chromosomenkondensation, hemmen kann [32].
Zhao et al. synthetisierten Palladiumhydrid (PdH)-Nanokristalle, um eine tumorspezifische photoakustische Bildgebung (PAI)-gesteuerte Wasserstoffthermotherapie zu entwickeln [33]. Um die Wasserstoff-Wärmetherapie mit PdH-Nanokristallen zu evaluieren, wurden zwei Modelle verwendet: eines mit 4T1-Brustkrebszellen, die subkutan in die Hinterpfotenhöhle von Mäusen injiziert wurden, und das andere mit B16-F10-Melanomzellen, die subkutan in die Hinterpfote von Nacktmäusen injiziert wurden. Nach der Implantation jedes Tumors wurden PdH-Nanokristalle injiziert, gefolgt von einer regelmäßigen Laserlichtbestrahlung, um die Antitumorwirkung zu untersuchen. Die Ergebnisse zeigten, dass die Kombination aus PdH-Nanokristallinjektion und Laserbestrahlung eine signifikante Unterdrückung des Tumorvolumens und -gewichts zeigte [33]. Darüber hinaus hatte die Kombination von PdH-Nanokristallen und Laserbestrahlung in Zellkulturexperimenten mit humanen HeLa-Gebärmutterhalskrebszellen und humanen fetalen Nierenzellen HEK-293T eine starke hemmende Wirkung auf HeLa-Zellen, nicht aber auf HEK-293T-Zellen. Aus diesen Ergebnissen berichteten Zhao et al., dass die photothermische Therapie mit erhöhter lokaler Produktion von H2-Gas in der Krebsbehandlung wirksam ist [33].
Das Glioblastom (GBM) ist die häufigste Form von primären bösartigen Hirntumoren. Liu et al. untersuchten die antitumorale Wirkung von H2-Gas (67%) auf GMB unter Verwendung eines orthotopen Gliommodells der Ratte und eines subkutanen Xenotransplantatmodells der Maus [34]. Die Inhalation von H2-Gas für 1 h zweimal täglich führte in beiden Modellen zu einer signifikanten Wachstumshemmung von GMB-Tumoren und zu einer signifikanten Verlängerung des Überlebens im Rattenmodell. Immunhistochemie und Immunfluoreszenzfärbung für Marker der Stammzellbildung (CD133 und Nestin), Proliferation (ki67) und Differenzierung (CD34) zeigten, dass die Inhalation von H2-Gas diese Marker in beiden Modellen signifikant reduzierte [34]. Die Inhalation von H2-Gas erhöhte auch die Expression des Differenzierungsmarkers glial fibrillary acidic protein (GFAP) signifikant. Ähnliche Ergebnisse wurden in einer In-vitro-Studie mit kultivierten Zellen erzielt. Aus diesen Ergebnissen schlossen Liu et al., dass H2 das Wachstum von GBM durch die Differenzierung von Gliom-Stammzellen hemmt [34].
Yang et al. berichteten über die Möglichkeit, dass die Pyroptose über den terminalen Proteingasder-min-D-Signalweg (GSDMD) an dem Mechanismus beteiligt sein könnte, durch den H2 seine antitumorale Wirkung auf Endometriumkrebs ausübt [35]. Die antitumorale Wirkung und die Mechanismen von H2 wurden in experimentellen Systemen untersucht, in denen humane Endometriumkarzinomzelllinien in vitro kultiviert und in Mäuse xenotransplantiert wurden. Die Ergebnisse zeigten, dass H2-reiches Wasser (1,2 ppm) die ROS-Produktion, die Expression von Pyrpoptose-verwandten Proteinen, die Anzahl der TUNEL-positiven Zellen und die Expression von GSDMD in In-vitro-Experimenten mit kultivierten Zelllinien erhöhte [35]. In-vivo-Experimente an Mäusen zeigten zudem, dass die orale Verabreichung von H2-reichem Wasser das Volumen und Gewicht von Tumoren reduzierte und dass die positiven Expressionen von NLRP3, Caspase-1 und GSDMD signifikant in Tumorgewebeschnitten von Mäusen der H2-reichen Wassergruppe beobachtet wurden. Yang et al. berichteten, dass der Mechanismus, durch den H2 das Wachstum von Endometriumkarzinomen hemmt, den pyrotrophen Weg über ROS/NLRP3/Caspase-1/GSDMD betrifft [35].
1.1.3. Antitumoreffekte in UV- oder ionisierenden Strahlungsmodellen
Wie im vorherigen Abschnitt beschrieben, berichteten Dole et al. in Science über die Wirksamkeit der hyperbaren Inhalation von 5 % Sauerstoff und 97,5 % H2-Gas bei Plattenepithelkarzinomen bei Mäusen, die durch UV-Bestrahlung induziert wurden [8]. Die Mäuse in der H2-Gruppe zeigten eine signifikante Hemmung des Wachstums und der Rückbildung des Plattenepithelkarzinoms im Vergleich zu Kontrollmäusen und Mäusen in der Gruppe, die eine hyperbare Inhalation von 5 % Sauerstoff und 97,5 % Heliumgas erhielten. Dole et al. schlugen in dieser Arbeit auch die Möglichkeit einer Explosion von H2-Gas vor [8]. Am
Gleichzeitig schlugen sie vor, dass der Mechanismus der Antitumoreffekte die selektive Eliminierung von ·OH von H2. Wie im vorherigen Abschnitt beschrieben, ist diese Arbeit die erste, die über die potenziellen medizinischen Anwendungen von H2-Gas als Antitumormittel berichtet [8].
Zhao et al. berichteten über die protektive Wirkung von H2-reicher Kochsalzlösung (1,2 ppm) gegen Thymuslymphome, die durch ionisierende Bestrahlung in BALB/c-Mäusen induziert wurden [36]. Die Kontrollgruppe erhielt 4 Wochen lang ionisierende Strahlung, und die H2-Gruppe erhielt 5 Minuten vor jeder ionisierenden Strahlenbehandlung eine intraperitoneale Verabreichung von H2-reicher Kochsalzlösung. Im Vergleich zur Kontrollgruppe zeigte die H2-Gruppe eine signifikante Verbesserung des Überlebens der Mäuse und eine Verringerung der Inzidenz von Lymphomen [36]. Die H2-Gruppe zeigte auch eine Hemmung der Produktion von ROS in peripheren mononukleären Blutzellen (PBMC). Des Weiteren zeigte die H2-Gruppe eine Abnahme von Malondialdehyd (MDA) und eine Zunahme von SOD und Glutathion (GSH) im Plasma [36]. Diese Ergebnisse deuten auf eine mögliche Wirksamkeit von H2 gegen Krebs hin, der durch ionisierende Bestrahlung induziert wird.
1.1.4. Hemmung der Karzinogenese im NASH-Modell
Oxidativer Stress ist stark an der Pathogenese von der einfachen Fettleber bis hin zu NASH, Fibrose und Hepatokarzinom beteiligt. Kawai et al. untersuchten die hemmende Wirkung von H2 auf die Progression zur Hepatokarzinogenese in einem STAM-Mausmodell [37]. Zwei Tage alte Mäuse wurden mit einer Einzeldosis Streptozotocin behandelt, um die Insulinsekretion zu reduzieren, und ab einem Alter von 4 Wochen mit einer fettreichen Diät gefüttert. H2-reiches Wasser (1,6 ppm) wurde den STAM-Mäusen 8 Wochen lang verabreicht und die Anzahl und Größe der Lebertumoren untersucht. Die H2-reiche Wassergruppe zeigte im Vergleich zur Kontrollgruppe eine signifikante Reduktion der Anzahl und Größe der Tumoren [37]. Die immunhistochemische Färbung des proliferierenden Zellkernantigens (PCNA) in der Leber zeigte, dass die Anzahl der PCNA-positiven Zellkerne in der H2-reichen Wassergruppe signifikant geringer war als in der Kontrollgruppe [37]. Diese Ergebnisse deuten darauf hin, dass H2-reiches Wasser das Fortschreiten der Fettleber zu NASH, Fibrose und Hepatokarzinom hemmen kann.
1.1.5. Hemmende Effekte auf die Angiogenese
Der vaskuläre endotheliale Wachstumsfaktor (VEGF) ist ein wichtiger Mediator der Tumorangiogenese. Tumorzellen sind einem höheren oxidativen Stress ausgesetzt als normale Zellen [38]. Der intrazelluläre Redoxzustand steht in engem Zusammenhang mit dem Expressionsmuster von VEGF. Ye et al. berichteten über die Auswirkungen von elektrolytisch reduziertem Wasser (ERW), das durch Wasserelektrolyse gewonnen wird, auf die Angiogenese und ihren Mechanismus unter Verwendung kultivierter Zellen [38]. In Kokulturexperimenten mit humanen Nabelvenen-Gefäß-Endothelzellen (HUVEC) und humanen diploiden embryonalen Lungenfibroblasten (TIG-1) hemmte ERW signifikant die Angiogenese. ERW reduzierte auch die Freisetzung von H2O2 aus A549-Zellen und verringerte die VEGF-Transkription und Proteinsekretion. Darüber hinaus hemmt ERW die Aktivierung der extrazellulären signalregulierten Kinase (ERK), die an der Regulation der VGEF-Expression beteiligt ist. Basierend auf diesen Ergebnissen schlugen Ye et al. vor, dass ERW die Transkription und Proteinsekretion des VEGF-Gens durch die Inaktivierung von ERK reduzieren könnte [38].
1.2. Antitumor-Effekte in klinischen Studien am Menschen
Die Inaktivierung des Peroxisom-Proliferator-aktivierten Rezeptors gamma coactivator-1α (PGC-1α) führt zu einer verminderten mitochondrialen Funktion, was zur Erschöpfung der CD8+ T-Zellen und zu einer verminderten Antitumorimmunität führt. Da berichtet wurde, dass H 2 die Aktivierung von PGC-1α verursacht, untersuchten Akagi et al. in einer 3-monatigen Inhalationsstudie bei 55 Patienten mit Darmkrebs im Stadium IV die Auswirkungen von H2-Gas (67%) auf die Immunfunktion [39]. Die Ergebnisse zeigten, dass H2-Gas die erschöpften terminalen PD-1+ CD8+ T-Zellen verringerte und aktivierte PD-1− CD8+ T-Zellen im peripheren Blut erhöhte, was das progressionsfreie Überleben (PFS) und das Gesamtüberleben (OS) signifikant verbesserte [39]. Aus diesen Ergebnissen schlugen Akagi et al. vor, dass das Gleichgewicht zwischen PD-1+ CD8+ T- und PD-1− CD8+ T-Zellen für die Krebsprognose wichtig ist und dass die Erholung erschöpfter CD8+ T-Zellen an dem Mechanismus beteiligt sein könnte, durch den H2-Gas seine antitumorale Wirkung ausübt [39].
Da vermutet wurde, dass H2-Gas die Prognose von Krebspatienten durch die Aktivierung von Mitochondrien verbessern kann, untersuchten Akagi et al. die Wirkung von Nivolumab in Kombination mit H2-Gas, das synergistisch mit mitochondrialen Aktivatoren ist [40]. Von 56 Lungenkrebspatienten, die mit Nivolumab behandelt wurden, erhielten 42 Patienten bis zu 60 Monate lang inhalatives H2und O2 -Gas (67 %: 33%). Die Ergebnisse zeigten, dass Patienten, die mit Nivolumab plus H2-Gasinhalation behandelt wurden, ein signifikant längeres Gesamtüberleben aufwiesen als Patienten, die nur mit Nivolumab behandelt wurden [40]. Bei diesen Patienten wurde auch der Coenzym Q10 (CoQ10)-Spiegel als Marker für die mitochondriale Funktion gemessen und eine multivariate Analyse der CoQ10-Spiegel und der PD-1+Tim-3+-terminalen CD8+ T-Zellen (PDT+) durchgeführt. Auf der Grundlage dieser Analyse schlugen Akagi et al. vor, dass H2-Gas die klinische Wirksamkeit von Nivolumab verbessern kann, indem es das mitochondriale CoQ10 erhöht und die PDT+ verringert [40].
Chen et al. behandelten 82 Krebspatienten mit inhaliertem HHO-Gas (67%:33%) für mindestens 3 h pro Tag über einen Zeitraum von mindestens 3 Monaten [41]. 34 % der Patienten wurden nur mit HHO-Gas-Inhalation behandelt, aber die restlichen 66 % der Patienten nahmen mehrere Krebsmedikamente in kleinen Dosen als Ergänzung zur HHO-Gas-Inhalation ein. Nach 4 Wochen hatten 41,5 % der Patienten eine Verbesserung der Lebensqualität (QOL), einschließlich Verbesserungen bei Müdigkeit, Schlaflosigkeit, Appetit und Schmerzen. Vollständige und partielle Remissionen traten zwischen 21 und 80 Tagen (Median 55 Tage) nach H2-Gasinhalation auf, mit einer Gesamterkrankungskontrollrate von 57,5 % [41]. Die Krankheitskontrollrate war bei Patienten im Stadium III signifikant höher als bei Patienten im Stadium IV (83,0 % bzw. 47,7 %), wobei die niedrigste Krankheitskontrollrate bei Patienten mit Bauchspeicheldrüsenkrebs zu verzeichnen war. Aus diesen Ergebnissen schlossen Chen et al., dass die Inhalation von H2-Gas eine Behandlung ist, die die Lebensqualität von Krebspatienten verbessern und das Fortschreiten der Krebserkrankung hemmen kann [41].
Chen et al. berichteten auch über die Ergebnisse einer Fallstudie zur HHO-Gas-Inhalationstherapie (67%:33%) bei Patienten mit metastasiertem Gallenblasenkrebs mit einer primären Lokalisation in der Leber [42,43]. Während einer einmonatigen H2-Gasinhalationstherapie (2–6 h/Tag) schritten die Gallenblasen- und Leberkarzinome weiter voran und wurden durch einen Darmverschluss erschwert. Parallel zur HHO-Gastherapie verbesserte sich jedoch allmählich die symptomatische Behandlung des Darmverschlusses und die Metastasen in der Bauchhöhle nahmen allmählich ab. Darüber hinaus verbesserte sich die Anämie der Patienten und ihre Lymphozyten- und Tumormarker kehrten auf ein normales Niveau zurück [42,43]. Sie berichteten, dass der Patient zweieinhalb Monate nach der HHO-Gasinhalation wieder ein normales Leben aufnehmen konnte und nach mehr als 10 Monaten noch am Leben ist [42,43]. Lungenkrebs ist ein sehr metastasierender Krebs, der sich auf die gegenüberliegende Lunge, den Knochen und das Gehirn ausbreiten kann. Daher berichteten Chen et al. auch über die Ergebnisse einer Fallstudie eines Patienten mit einem Hirntumor, der mehrere Metastasen von Lungenkrebs aufwies [44]. Die Patientin wurde mit einer Standardtherapie behandelt, die keine Wirkung zeigte, und die Metastasen wurden von der Lunge auf das Gehirn, die Knochen, die Nebennieren und die Leber übertragen. Nach 4-monatiger Monotherapie mit H2-Gas (67%) für 2–6 h pro Tag war die Größe mehrerer Hirntumoren signifikant reduziert, ebenso wie die Menge an Rückenmarksflüssigkeit aus dem Hydrozephalus, die mit den Hirntumoren assoziiert war. Sie berichteten, dass nach einem Jahr alle Hirntumore verschwunden waren und die Größe der Lungen- und Leberkarzinome unter Kontrolle zunahm[44].
Chen et al. teilten 58 Patienten mit fortgeschrittenem nicht-kleinzelligem Lungenkrebs in fünf Gruppen ein: Kontrolle (10 Patienten), H 2 allein (10 Patienten), H2 plus Chemotherapie (10 Patienten), H2 plus zielgerichtete Therapie (18 Patienten) und H2 plus Immuntherapie (10 Patienten) [45]. Alle Gruppen mit Ausnahme der Kontrollgruppe erhielten 5 Monate lang eine HHO-Gasinhalation (67 %), 33% für 4–5 h pro Tag. In den ersten fünf Monaten der Behandlung nahm die Prävalenz der Symptome in der Kontrollgruppe allmählich zu, während sie in den vier Behandlungsgruppen abnahm. Die 16-monatige Nachbeobachtung zeigte, dass die progressionsfreien Überlebensraten in den Gruppen H2 allein, H2 plus Chemotherapie, H2 plus zielgerichtete Therapie und H2 plus Immuntherapie signifikant höher waren als in der Kontrollgruppe [45]. Die meisten Nebenwirkungen von Medikamenten wurden in der Kombinationstherapiegruppe reduziert oder eliminiert. Aus diesen Ergebnissen schlossen Chen et al., dass inhaliertes H2-Gas verwendet werden kann, um das Fortschreiten des Tumors zu reduzieren und die Nebenwirkungen von Medikamenten bei Patienten zu lindern [45].
Chen et al. nahmen auch 20 Patienten mit nicht-kleinzelligem Lungenkrebs auf und untersuchten die Immunseneszenz von peripheren Blutlymphozyten-Untergruppen, einschließlich T-Zellen, natürlichen Killer-T-Zellen und Gamma-Delta (γδ) T-Zellen [46]. Während der Wartezeit für die Tests zur Behandlung wurden die Patienten 2 Wochen lang mit 4 Stunden täglicher HHO-Gas (67%:33) Inhalation behandelt, und keiner der Patienten erhielt eine Standardbehandlung. Nach 2-wöchiger H2-Behandlung sanken die erschöpften und seneszenten zytotoxischen T-Zellen auf normale Grenzen, und die Killer-Vδ1-Zellen nahmen zu. Zu den abnorm reduzierten Indikatoren gehörten funktionelle T-Helferzellen und zytotoxische T-Zellen, Th1, natürliche Killer-T-Zellen, natürliche Killerzellen und Vδ2-Zellen. Basierend auf diesen Ergebnissen berichteten sie, dass eine 2-wöchige H2-Gasinhalation die adaptive und angeborene Immunseneszenz bei Patienten mit fortgeschrittenem nicht-kleinzelligem Lungenkrebs signifikant umkehren könnte [46].
2. Mögliche Mechanismen der antitumoralen Wirkung von H2
Viele zelluläre, tierische und klinische Studien haben gezeigt, dass H2 eine hervorragende Anti-Tumor-Wirkung hat [25–46]. Es gibt jedoch nur wenige Berichte über die Mechanismen der Antitumorwirkung von H2. Basierend auf diesen Berichten schlagen wir vor, dass die Mechanismen der antitumoralen Wirkung von H2 nicht nur das direkte Abfangen von ·OH, sondern auch indirekte Effekte wie Antioxidation, Anti-Entzündung, Apoptose oder Pyroptose über die Regulation der Genexpression (Abbildung 2).
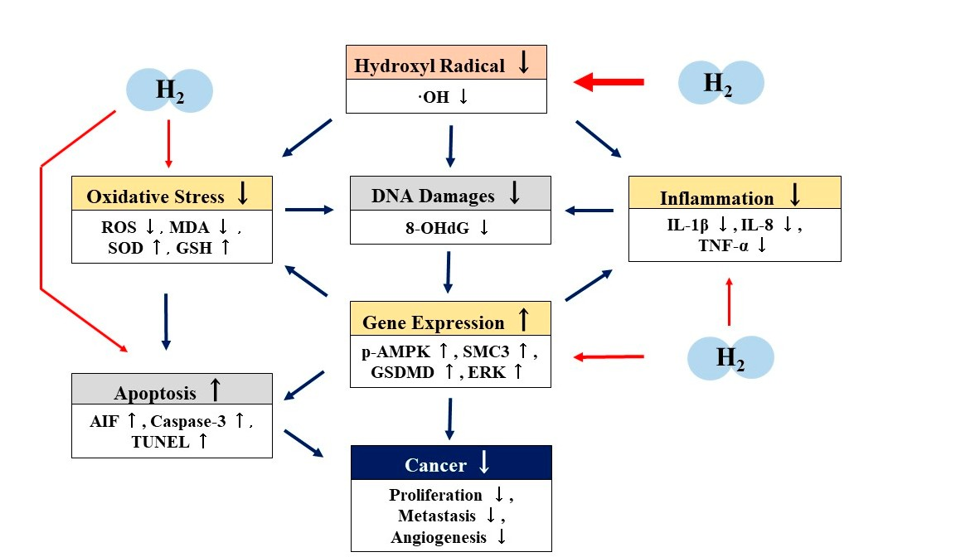
Abbildung 2. Möglicher Mechanismus der Antitumorwirkung von molekularem Wasserstoff (H2). H2 fängt Hydroxylradikale (·OH) direkt ab. H2 weist durch die indirekte Regulierung der Genexpression auch antioxidative, entzündungshemmende und apoptotische Wirkungen auf. Durch diese direkten und indirekten Wirkungen kann H2 eine Antitumorwirkung entfalten. H2: molekularer Wasserstoff; ·OH: Hydroxylradikale; ROS: reaktive Sauerstoffspezies; MDA: Malondialdehyd; SOD: Superoxiddismutase; GSH: Glutathion; 8-OHdG: 8-Hydroxy-2t-desoxyguanidin; p-AMPK: phosphorylierte Adenosinmonophosphat-aktivierte Proteinkinase; AIF: Apoptose-induzierender Faktor; TUNEL: TdT-vermittelte Digoxygenin (Biotin)-dUTP-Nick-End-Markierung; SDMD: Gasdermin D; ERK: extrazelluläre signalregulierte Kinase; IL-1β: Interleukin-1β; IL-8: Iterleukin-8; TNFα: Tumornekrosefaktor-α.
Die Hemmung von ·OH oder Gesamt-ROS-Produktion in den Antitumoreffekten von H2 wurden in vielen Arbeiten beschrieben [25–27,31–33,36]. Wang et al. berichteten über eine erhöhte SOD-Aktivität, eine unterdrückte Expression von IL-1β, IL-8, TNF-α und eine verstärkte Apoptose in der Antitumorwirkung von H2 [32]. Zhao et al. berichteten, dass H2 die SOD- und GSH-Aktivitäten erhöht, während MDA verringert wird [36], und Yang et al. berichteten, dass H2 die Pyroptose verstärkt [35]. Auf der anderen Seite berichteten Runtuwene et al. in Bezug auf die Genexpression im Zusammenhang mit diesen Antitumoreffekten über die erhöhte Expression von p-AMPK, AIF und Caspase-3 in den Antitumoreffekten von H2 durch Western-Blot-Analyse [31]. Wang et al. berichteten über die Repression der SMC3-Expression durch H2 in der Western-Blot-Analyse und immunhistochemischen Analyse [32], und Yang et al. berichteten über die erhöhte Expression von GSDMD durch H2 in Experimenten zur Untersuchung der mRNA-Expression [35]. Ye et al. berichteten über eine Hemmung der ERK-Aktivierung, die an der Regulation der VGEF-Expression beteiligt ist, in einem experimentellen System zur Angiogenese mit kultivierten Zellen [38]. Darüber hinaus zeigten Kawai et al., dass das Trinken von H2-Wasser in einem anderen experimentellen NASH-Modell, das durch eine fettreiche Ernährung induziert wurde, die Plasmaspiegel von 8-OHdG signifikant senkte [37].
Der Mechanismus der Antitumorwirkung von H2-Gas in klinischen Studien am Menschen wurde von Akagi et al. [39,40] und Chen et al. [42,43] beschrieben. Bei Krebspatienten ist die mitochondriale Funktion durch die Inaktivierung von PGC-1α reduziert. Sie berichteten jedoch, dass die Inhalation von H2-Gas PGC-1α und die Antitumorimmunität aktivierte, indem sie die PD-1− CD8+ T-Zellen erhöhte. In ähnlicher Weise berichteten Chen et al., dass die Inhalation von H2-Gas die adaptive und angeborene Immunseneszenz bei Krebspatienten verbesserte [46]. Obwohl nur über eine Abnahme der Antitumorimmunität bei Krebspatienten berichtet wird, kann diese Abnahme auf eine beeinträchtigte mitochondriale Funktion zurückgeführt werden, wobei einer dieser Faktoren oxidativer Stress ist. Es ist bekannt, dass ROS-induzierter oxidativer Stress mtDNA-Mutationen und eine Abnahme des mtDNA-Spiegels verursacht, was letztendlich zu einer mitochondrialen Dysfunktion, einschließlich einer Dysfunktion der Atmungskette, führt. Kamimura et al. berichteten, dass die erhöhte Expression des PGC-1α-Gens an dem Mechanismus beteiligt ist, durch den die H2-Wassergabe in adipösen Mausmodellen den Fettstoffwechsel verbessert [66]. Obwohl weitere detaillierte mechanistische Studien erforderlich sind, ist es möglich, dass die Aktivierung der Antitumorimmunität durch H2-Gas nicht nur das direkte Abfangen von ·OH, sondern auch biologische Abwehrmechanismen durch die Regulation der Genexpression (Abbildung 2).
Die Reaktionsgeschwindigkeit von H2
·Es wird berichtet, dass OH in wässriger Lösung viel langsamer ist als solche mit DNA, Aminosäuren, Zuckern und GSH [67]. Die Reaktionsgeschwindigkeit zwischen ·OH und H2 in wässriger Lösung gelten nicht für die hohe Konzentration biologischer Komponenten im Zytoplasma und Zellkern. Da H2 das kleinste Molekül ist und eine hohe Diffusionsrate hat, kann die Diffusionsrate von H2 in die Mitochondrien und den Zellkern dazu beitragen; H2 kann durch biologische Membranen diffundieren, um die Mitochondrien zu erreichen, den Hauptort von ·OH-Produktion und Reparaturmutationen in der mtDNA [11,12]. Da jedoch·OH eine sehr kurze Halbwertszeit hat[68], es ist unwahrscheinlich, dass das in den Mitochondrien produzierte OH in den Zellkern wandert und reagiert dort mit der Kern-DNA. Vielmehr besteht die Möglichkeit, dass ·OH, das durch Bestrahlungsanregung aus Wassermolekülen im Kern erzeugt wird, mit DANN reagiert. Darüber hinaus kann H2O2 im Zellkern ·OH durch UV-Bestrahlung oder die Verstärkung der Fenton-Reaktion, und diese ·OH kann auch eine Mutation der Kern-DNA verursachen. Daher kann H2 effizient reduzieren ·OH entsteht nicht nur in Mitochondrien, sondern auch im Zellkern und schützt so die Kern-DNA vor Mutationen.
1. Perspektiven von H2 als Antitumormittel
Die medikamentöse Therapie (Chemotherapie) ist eine der wichtigsten Behandlungsmöglichkeiten bei Krebserkrankungen. Die Chemotherapie mit Antitumormitteln kann allein oder in Kombination mit einer prä- oder postoperativen Strahlentherapie eingesetzt werden. Alkylierungsmittel [69], Stoffwechselantagonisten [70], Antitumorantibiotika [71] und pflanzliche Alkaloide [72] werden seit langem klinisch als Antitumormittel eingesetzt, aber diese Mittel schädigen nicht nur Krebszellen, sondern auch normale Zellen. Während die Mechanismen der Nebenwirkungen dieser Medikamente untersucht wurden und auch ihre Derivate und neue Antitumorwirkstoffe mit weniger Nebenwirkungen entwickelt wurden [73–76], ist das Problem der Nebenwirkungen nicht zufriedenstellend gelöst. In jüngerer Zeit wurden molekular zielgerichtete Wirkstoffe entwickelt, Nukleinsäuremedikamente und Immun-Checkpoint-Inhibitoren eingeführt [5,6]. Trotz der Erweiterung der therapeutischen Optionen bestehen jedoch nach wie vor Bedenken hinsichtlich der Wirksamkeit und Sicherheit, und die Entwicklung eines neuartigen Antitumorwirkstoffs mit höherer Wirksamkeit und zuverlässiger Sicherheit ist wünschenswert. ROS-induzierter oxidativer Stress kann Mutationen in normalen Zellen verursachen und deren Umwandlung in Krebszellen fördern [77,78]. ROS fördern auch die Stabilisierung von Faktoren, die die Krebsentstehung und -progression fördern [77,78].
Daher ist eine Methode, um ROS im Körper zu eliminieren und oxidativen Stress durch Antioxidantien zu reduzieren, vielversprechend für die Prävention und Behandlung von Krebs. Daher wurde eine große klinische Studie mit Vitamin-E-Supplementierung durchgeführt [79]. Die Ergebnisse waren jedoch entgegen den Erwartungen: Es kam zu einem signifikanten Anstieg der Inzidenz von Prostatakrebs bei Patienten, die Vitamin E erhielten [79,80]. Auch Studien an Krebsmodellen der Maus bestätigten die beschleunigte Wirkung einer Supplementierung mit N-Acetylcystein und Vitamin E auf die Krebsentstehung [81]. Die Mechanismen, durch die diese Antioxidantien das Krebswachstum fördern, wurden von DeNicola et al. und Schäfer et al. beschrieben [82,83]. Aus diesen Ergebnissen geht hervor, dass die Wirkung von Antioxidantien auf Krebs beidseitig ist und dass sie je nach Bedingungen die Krebsentwicklung entweder hemmen oder fördern können. Die am häufigsten vorkommende ROS im Körper ist O2−, gefolgt von H2O2, obwohl · OH hat die stärkste Oxidationskraft. Die meisten Antioxidantien, mit Ausnahme von H2, sind nicht selektiv für ·OH, aber sie sind in der Lage, O2− und H2O2 abzufangen, die im Körper wichtige Rollen wie Infektionskontrolle und Signalübertragung spielen [11,12]. H2 hingegen frisst nur ·OH ist die am häufigsten vorkommende Form von ROS in Mitochondrien und hat keine direkten Fängereffekte auf andere ROS wie O2− oder H2O2 [11–13]. Die geringe Molekülgröße von H2 ermöglicht es ihm, Zellmembranen schnell zu durchdringen und in das Zytoplasma zu diffundieren [11–13,53,57]. Es erreicht dann innerhalb kurzer Zeit den Zellkern und die Mitochondrien der Zelle und schützt sowohl die Kern-DNA als auch die mtDNA [11–13]. Andere Antioxidantien haben jedoch eine viel geringere Durchlässigkeit in der Zelle als H2 [11,12]. Dieser Unterschied in der Selektivität für ROS und intrazelluläre Kinetik könnte dafür verantwortlich sein, dass H2 antitumorale Wirkungen zeigt, während andere Antioxidantien je nach Bedingungen sowohl antitumoral als auch prokarzinogen wirken.
Akagi et al. berichteten, dass die Mechanismen der Antitumorwirkung von H2-Gas die Abnahme von PD-1+ CD8+ T-Zellen und die Zunahme von PD-1− CD8+ T-Zellen beinhalten [39,40]. Aufgrund dieser Ergebnisse kann davon ausgegangen werden, dass H2 auch eine proinflammatorische Aktivität aufweist. In vielen Studien wurden kontraindiktorische Effekte festgestellt, da H2 eine proinflammatorische Aktivität und immunpotenzierende Effekte zeigen kann, während es auch entzündungshemmende und immunsuppressive Wirkungen besitzt [39,40,84–86]. Dies mag widersprüchlich erscheinen, aber H2 kann je nach Versuchsbedingungen als doppelseitig angesehen werden. Mit anderen Worten,H2 zeigt sowohl eine proinflammatorische als auch eine entzündungshemmende Wirkung auf das Entzündungssystem sowie eine potenzierende und unterdrückende Wirkung (immunmodulierende Aktivität) auf das Immunsystem. Dies deutet darauf hin, dass die Auswirkungen von H2 auf Entzündungen und Immunität immer als Potenzierer oder Hemmstoff wirken, um die Homöostase des Körpers aufrechtzuerhalten.
In dieser Studie über die antitumorale Wirkung von H2 wurden verschiedene Anwendungsmethoden zur Aufnahme von H2 verwendet, darunter die Inhalation von HHO-Gas, die Einnahme von H2-reichem Wasser und die intraperitoneale Injektion von H2-reicher Kochsalzlösung. Jede dieser Verabreichungsmethoden hat ihre eigenen Eigenschaften, aber wir glauben, dass die Inhalation von H2-Gas zeitabhängig die höchste Menge an H2 liefern kann. Dies erklärt sich dadurch, dass die maximale Blut- und Gewebekonzentration (Cmax) der H2-Gasinhalation niedriger ist als bei anderen Verabreichungswegen, während die Fläche unter der Kurve (AUC) extrem hoch ist [87,88]. Auf der anderen Seite können wir diese Studien in zwei Gruppen einteilen: diejenigen, die die Wirkung von H2 allein untersuchten, und diejenigen, die die Wirkung von H2 in Kombination mit anderen Medikamenten untersuchten. Die Kombinationsstudien umfassen beispielsweise die Kombination von H2-gelöstem Wasser mit Platinkolloid [26,28], die Kombination von H2-Wasser mit 5-Fu [31] und die Kombination von H2-Gas mit Nivolumab [40]. Da alle diese Studien, die die kombinierten Wirkungen untersuchten, größere Effekte zeigten als das H2 allein, kann davon ausgegangen werden, dass die Kombination von H2 und diesen Wirkstoffen die Unzulänglichkeiten der Effekte von H2 allein kompensiert und additive oder synergistische Effekte zeigt.
Die Forschungsgeschichte für H2 ist extrem alt, da die antitumorale Wirkung von H2 erstmals 1975 von Dole et al. beschrieben wurde [8]. Es wurde jedoch erst vor kurzem berichtet, dass H2 eine Antitumoraktivität zeigt, insbesondere in klinischen In-vivo- und Humanstudien, und die Antitumoreigenschaften von H2 wurden nicht hervorgehoben. Wie in diesem Review beschrieben, hat H2 in verschiedenen zellulären Modellen, Tiermodellen und klinischen Studien am Menschen eine hervorragende Antitumoraktivität gezeigt [25–46]. Mehr als 1000 Artikel wurden zum Thema medizinische Anwendungen von H2, darunter mehr als 80 Berichte über klinische Studien am Menschen veröffentlicht[55]. Diese Arbeiten bestätigen, dass H2 bei einer Vielzahl von Krankheiten hochwirksam ist und dass es keine Sicherheitsprobleme gibt. Im Bereich der medikamentösen Therapie von Krebs werden neue Medikamente wie Nukleinsäuremedikamente [5] und Immun-Checkpoint-Inhibitoren [6] entwickelt, wobei es viele Probleme mit ihrer Wirksamkeit und Sicherheit gibt. Daher könnte die klinische Anwendung von H2 als neuartiger Antitumorwirkstoff möglicherweise einen neuen Weg im Bereich der Krebsbehandlung ebnen.
FAZIT
Es wurde berichtet, dass H2 bei vielen Krankheiten eine ausgezeichnete Wirksamkeit und Sicherheit aufweist [15–24]. In jüngster Zeit wurden mehrere Forschungsstudien zur Wirksamkeit von H2 gegen Krebs und zur Verbesserung der Nebenwirkungen der Krebsbehandlung berichtet [25–46]. Es gibt jedoch keine Übersichtsarbeiten, die das Potenzial von H2 als neuartiger Antitumorwirkstoff mit klinischen Anwendungen und Analysen seiner Mechanismen skizzieren. In dieser Arbeit haben wir die Wirksamkeit und die Mechanismen von H2 als neuartigen Antitumorwirkstoff aus Sicht der Genexpression untersucht. H2 zeigt eine ausgezeichnete Antitumorwirksamkeit in zellulären Modellen, Tiermodellen und klinischen Studien am Menschen [25–46], und der Wirksamkeitsmechanismus kann nicht nur das direkte Abfangen von ·OH durch H2, sondern auch die indirekten biologischen Abwehrmechanismen über die Regulation der Genexpression. H2 hat sich als Antitumormittel als hervorragende Wirksamkeit und Sicherheit erwiesen, und seine klinische Anwendung könnte eine neue therapeutische Strategie gegen Krebs darstellen.
Autorenbeiträge: Konzeptualisierung, S.-i.H.; Untersuchung, S.-i.H.; Schreiben – Originalentwurfserstellung, S.-i.H.; Schreiben – Begutachten und Lektorat, S.-i.H., H.Y., Y.I., B.S., Y.T. und F.S. Alle Autoren haben die veröffentlichte Version des Manuskripts gelesen und sind damit einverstanden.
Förderung: Diese Forschung erhielt keine Drittmittel. Erklärung des Institutional Review Board: Nicht zutreffend. Einwilligungserklärung: Nicht zutreffend.
Erklärung zur Datenverfügbarkeit: Die in dieser Studie vorgestellten Daten sind auf Anfrage beim korrespondierenden Autor erhältlich.
Danksagung: Die Autoren bedanken sich bei Yoko Satoh und Susumu Mine (MiZ Company Limited) für ihre hervorragende Beratung beim Schreiben dieses Manuskripts.
Interessenkonflikte: Die Autoren erklären keinen Interessenkonflikt.
Referenzen
1. National Cancer Institute. What Is Cancer? Available online: https://www.cancer.gov/about-cancer/understanding/what-is- cancer (accessed on 2 July 2021).
2. Sung, H.; Ferlay, J.; Siegel, R.L.; Laversanne, M.; Soerjomataram, I.; Jemal, A.; Bray, F. Global cancer statics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J. Clin. 2021, 71, 209–249. [CrossRef]
3. Kindler, H.L. Malignant pleural mesothelioma. Curr. Treat. Options Oncol. 2000, 1, 313–326. [CrossRef] [PubMed]
4. Lee, Y.T.; Tan, Y.J.; Oon, C.E. Molecular targeted therapy: Treating cancer with specificity. Eur. J. Pharmacol. 2018, 834, 188–196. [CrossRef]
5. Opalinska, J.B.; Gewirtz, A.M. Nucleic-acid therapeutics: Basic principals and recent applications. Nat. Rev. Drug Discov. 2002, 1, 503–514. [CrossRef] [PubMed]
6. Xu, C.; Chen, Y.P.; Du, X.J.; Liu, J.Q.; Huang, C.L.; Chen, L.; Zhou, G.Q.; Li, W.F.; Mao, Y.P.; Hsu, C. Comparative safety of immune checkpoint inhibitors in cancer: Systematic review and network meta-analysis. BMJ 2018, 363, k4226. [CrossRef]
7. Vasan, N.; Baselga, J.; Hyman, D.M. A view on drug resistance in cancer. Nature 2019, 575, 299–309. [CrossRef]
8. Dole, M.; Wilson, F.R.; Fife, W.P. Hyperbaric hydrogen therapy: A possible treatment for cancer. Science 1975, 190, 152–154. [CrossRef]
9. Ohsawa, I.; Ishikawa, M.; Takahashi, K.; Watanabe, M.; Nishimaki, K.; Yamagata, K.; Katsura, K.I.; Katayama, Y.; Asoh, S.; Ohta,
S. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals. Nat. Med. 2007, 13, 688–694. [CrossRef]
10. Yanagihara, T.; Arai, K.; Miyamae, K.; Sato, B.; Shudo, T.; Yamada, M.; Aoyama, M. Electrolyzed hydrogen-saturated water for drinking use elicits an antioxidative effect; a feeding test with rats. Biosci. Biotrechnol. Biochem. 2005, 69, 1985–1987. [CrossRef] [PubMed]
11. Ohta, S. Molecular hydrogen as a preventive and therapeutic medical gas: Initiation, development and potential of hydrogen medicine. Pharmacol. Ther. 2014, 144, 1–11. [CrossRef]
12. Ohta, S. Molecular hydrogen as a novel antioxidant: Overview of the advantages of hydrogen for medical applications. Methods Enzymol. 2015, 555, 289–317.
13. Hirano, S.-i.; Ichikawa, Y.; Sato, B.; Satoh, F.; Takefuji, Y. Hydrogen is promising for medical applications. Clean Technol. 2020, 2, 529–541. [CrossRef]
14. Hirano, S.-i.; Ichikawa, Y.; Kurokawa, R.; Takefuji, Y.; Satoh, F. A “philosophical molecule,” hydrogen may overcome senescence and intractable diseases. Med. Gas Res. 2020, 10, 47–49. [CrossRef]
15. Ono, H.; Nishijima, Y.; Adachi, N.; Tachibana, S.; Chitoku, S.; Mukaihara, S.; Sakamoto, M.; Kudo, Y.; Nakazawa, J.; Kaneko, K.; et al. Improved brain MRI indices in the acute brain stem infarct sites treated with hydroxyl radical scavengers, Edaravone and hydrogen, as compared to Edaravone alone. A non-controlled study. Med. Gas Res. 2011, 1, 12. [CrossRef] [PubMed]
16. Yoritaka, A.; Takanashi, M.; Hirayama, M.; Nakahara, T.; Ohta, S.; Hattori, N. Pilot study of H2 therapy in Parkinson’s disease. A randomized double-blind placebo-controlled trial. Mov. Disord. 2013, 28, 836–839. [CrossRef] [PubMed]
17. Ono, H.; Nishijima, Y.; Ohta, S.; Sakamoto, M.; Kinone, K.; Horikoshi, T.; Tamaki, M.; Takeshita, H.; Futatuki, T.; Ohishi, W.; et al. Hydrogen gas inhalation treatment in acute cerebral infarction: A randomized controlled clinical study on safety and neuroprotection. J. Stroke Cerebrovasc. 2017, 26, 2587–2594. [CrossRef] [PubMed]
18. Katsumata, Y.; Sano, F.; Abe, T.; Tamura, T.; Fujisawa, T.; Shiraishi, Y.; Khosaka, S.; Ueda, I.; Honmma, K.; Suzuki, M.; et al. The effects of hydrogen gas inhalation on adverse left ventricular remodeling after percutaneous coronary intervention for ST-elevated myocardial infraction. First pilot study in humans. Circ. J. 2017, 81, 940–947. [CrossRef]
19. Tamura, T.; Hayashida, K.; Sano, M.; Suzuki, M.; Shibusawa, T.; Yoshizawa, J.; Kabayashi, Y.; Suzuki, T.; Ohta, S.; Morisaki, H.; et al. Feasibility and safety of hydrogen gas inhalation for post-cardiac arrest syndrome. Circ. J. 2016, 80, 1870–1873. [CrossRef]
20. Guan, W.J.; Wei, C.H.; Chen, A.L.; Sun, X.C.; Guo, G.Y.; Zou, X.; Shi, J.D.; Lai, P.Z.; Zheng, Z.G.; Zhong, N.S. Hydrogen/oxygen mixed gas inhalation improves disease severity and dyspnea in patients with Coronavirus disease 2019 in a recent multicenter, open-label clinical trial. J. Thorac. Dis. 2020, 12, 3448–3452. [CrossRef]
21. Gong, Z.; Guan, J.; Ren, X.; Meng, D.; Zhang, H.; Wang, B.; Yan, X. Protective effect of hydrogen on the lung of sanitation workers exposed to haze. Chin. J. Tuberc. Respir. Dis. 2016, 39, 916–923.
22. Kajiyama, S.; Hasegawa, G.; Asano, M.; Hosoda, H.; Fukui, M.; Nakamura, N.; Kitawaki, J.; Imai, S.; Nakano, K.; Ohta, M.; et al. Supplementation of hydrogen-rich water improves lipid and glucose metabolism in patients with type 2 diabetes or impaired glucose tolerance. Nutr. Res. 2008, 28, 137–143. [CrossRef]
23. Xia, C.; Liu, W.; Zeng, D.; Zhu, L.; Sun, X.; Sun, X. Effect of hydrogen-rich water on oxidative stress, liver function, and viral load in patients with chronic hepatitis B. Clin. Trans. Sci. 2013, 6, 372–375. [CrossRef]
24. Song, G.; Li, M.; Sang, H.; Zhang, L.; Li, X.; Yao, S.; Yu, Y.; Zong, C.; Xue, Y.; Qin, S. Hydrogen-rich water decreases serum low-density lipoprotein cholesterol levels and improves high-density lipoprotein function in patients with potential metabolic syndrome. J. Lipid Res. 2013, 54, 1884–1893. [CrossRef]
25. Saitoh, Y.; Okayasu, H.; Xiao, L.; Harata, Y.; Miwa, N. Neutral pH hydrogen-enriched electrolyzed water achieves tumor- preferential clonal growth inhibition over normal cells and tumor invasion inhibition concurrently with intracellular oxidant repression. Oncol. Res. 2008, 17, 247–255. [CrossRef]
26. Saitoh, Y.; Yoshimura, Y.; Nakano, K.; Miwa, N. Platinum nanocolloid-supplemented hydrogen-dissolved water inhibits growth of human tongue carcinoma cells preferentially over normal cells. Exp. Oncol. 2009, 31, 156–162. [PubMed]
27. Asada, R.; Kageyama, K.; Tanaka, H.; Matsui, H.; Kimura, M.; Saitoh, Y.; Miwa, N. Antitumor effects of nano-bubble hydrogen- dissolved water are enhanced by coexistent platinum colloid and the combined hyperthermia with apoptosis-like cell death. Oncol. Rep. 2010, 24, 1463–1470. [PubMed]
28. Saitoh, Y.; Ikeshima, M.; Kawasaki, N.; Masumoto, A.; Miwa, N. Transient generation of hydrogen peroxide is responsible for carcinostatic effects of hydrogen combined with platinum nanocolloid, together with increase intracellular ROS, DNA cleavages, and proportion of G2/M-phase. Free Radic. Res. 2016, 50, 385–395. [CrossRef]
29. Kato, S.; Saitoh, Y.; Miwa, N. Carcinostatic effects of alkanoyl ascorbate plus platinum nano-colloid and stabilization of the esterolytically resultant ascorbate by hydrogen. Hum. Cell 2021, 34, 436–444. [CrossRef] [PubMed]
30. Kagawa, A.; Katsura, K.; Mizumoto, M.; Tagawa, Y.; Mashiko, Y. Influence of hydrogen discharged from palladium base hydrogen storage alloys on cancer cells. Mater. Sci. Forum 2012, 706–709, 520–525. [CrossRef]
31. Runtuwene, J.; Amitani, H.; Amitani, M.; Asakawa, A.; Cheng, K.C.; Inui, K. Hydrogen-water enhances 5-fluorouracil-induced inhibition of colon cancer. PeerJ 2015, 3, e859. [CrossRef]
32. Wang, D.; Wang, L.; Zhang, Y.; Zhao, Y.; Chen, G. Hydrogen gas inhibits lung cancer progression through targeting SMC3. Biomed. Pharmacol. 2018, 104, 788–797. [CrossRef]
33. Zhao, P.; Jin, Z.; Chen, Q.; Yang, T.; Chen, D.; Meng, J.; Lu, X.; Gu, Z.; He, Q. Local generation of hydrogen for enhanced photothermal therapy. Nat. Commun. 2018, 9, 4241. [CrossRef]
34. Liu, M.U.; Xie, F.; Zhang, Y.; Wang, T.T.; Ma, S.N.; Zhao, P.X.; Zhang, X.; Lebaron, T.W.; Yan, X.L.; Ma, X.M. Molecular hydrogen suppresses glioblastoma growth via inducing the glioma stem-like cell differentiation. Stem Cell Res. Ther. 2019, 10, 145. [CrossRef] [PubMed]
35. Yang, Y.; Liu, P.Y.; Bao, W.; Chen, S.J.; Wu, F.S.; Zhu, P.Y. Hydrogen inhibits endometrial cancer growth via a ROS/NLRP3/Caspase- 1/GSDMD-mediated pyroptotic pathway. BMC Cancer 2020, 20, 28. [CrossRef] [PubMed]
36. Zhao, L.; Zhou, C.; Zhang, J.; Gao, F.; Li, B.; Chuai, Y.; Liu, C.; Cai, J. Hydrogen protects mice from radiation induced thymic lymphoma in BALB/c mice. Int. J. Biol. Sci. 2011, 7, 297–300. [CrossRef] [PubMed]
37. Kawai, D.; Takaki, A.; Nakatsuka, A.; Wada, J.; Tamaki, N.; Yasunaka, T.; Koike, K.; Tsuzaki, R.; Matsumoto, K.; Miyake, Y.; et al. Hydrogen-rich water prevents progression of nonalcoholic steatohepatitis and accompanying hepatocarcinogenesis in mice. Hepatology 2012, 56, 912–921. [CrossRef]
38. Ye, J.; Li, Y.; Hamasaki, T.; Nakamichi, N.; Komatsu, T.; Kashiwagi, T.; Teruya, K.; Nishikawa, R.; Osada, K.; Toh, K.; et al. Inhibitory effect of electrolyzed reduced water on tumor angiogenesis. Biol. Pharm. Bull. 2008, 31, 19–26. [CrossRef]
39. Akagi, J.; Baba, H. Hydrogen gas restores exhausted CD8+ T cells in patients with advanced colorectal cancer to improve prognosis. Oncol. Rep. 2018, 41, 301–311. [CrossRef]
40. Akagi, J.; Baba, H. Hydrogen gas activates coenzyme Q10 to restore exhausted CD8+ T cells, especially PD-1+Timterminal CD8+
T cells, leading to better nivolumab outcomes in patients with lung cancer. Oncol. Lett. 2020, 20, 258. [CrossRef]
41. Chen, J.B.; Kong, X.F.; Lv, Y.Y.; Qin, S.C.; Sun, X.J.; Mu, F.; Lu, T.Y.; Xu, K.C. “Real world survey” of hydrogen-controlled cancer: A follow-up report of 82 advanced cancer patients. Med. Gas Res. 2019, 9, 115–121.
42. Chen, J.B.; Pan, Z.B.; Du, D.M.; Qian, W.; Ma, Y.Y.; Mu, F.; Xu, K.C. Hydrogen gas therapy shrinkage of metastatic gallbladder cancer: A case report. World J. Clin. Cases 2019, 7, 2065–2074. [CrossRef] [PubMed]
43. Chen, J.; Mu, F.; Lu, T.; Ma, Y.; Du, D.; Xu, K. A gallbladder carcinoma patient with pseudo-progressive remission after hydrogen inhalation. Onco Targets Ther. 2019, 12, 8645–8651. [CrossRef]
44. Chen, J.; Mu, F.; Lu, T.; Du, D.; Xu, K. Brain metastases completely disappear in non-small cell lung cancer using hydrogen gas inhalation: A case report. Onco Target Ther. 2019, 12, 11145–11151. [CrossRef]
45. Chen, J.B.; Kong, X.F.; Mu, F.; Lu, T.Y.; Lu, Y.Y.; Xu, K.C. Hydrogen therapy can be used to control tumor progression and alleviate the adverse events of medications in patients with advanced non-small cell lung cancer. Med. Gas Res. 2020, 10, 75–80. [PubMed]
46. Chen, J.B.; Kong, X.F.; Qian, W.; Mu, F.; Lu, T.Y.; Lu, Y.Y.; Xu, K.C. Two weeks of hydrogen inhalation can significantly reverse adaptive and innate immune system senescence patients with advanced non-small cell lung cancer: A self-controlled study. Med. Gas Res. 2020, 10, 149–154.
47. Compagni, A.; Christofori, G. Recent advances in research on multistage tumorigenesis. Br. J. Cancer 2000, 83, 1–5. [CrossRef] [PubMed]
48. Levine, A.J.; Oren, M. The first 30 years of p53: Growing ever more complex. Nat. Rev. Cancer 2009, 9, 749–758. [CrossRef]
49. Sigal, A.; Rotter, V. Oncogenic mutations of the p53 tumor suppressor: The demons of the guardian of the genome. Cancer Res.
2000, 60, 6788–6793. [PubMed]
50. Vousden, K.H.; Lu, X. Live or let die: The cell’s response to p53. Nat. Rev. Cancer 2002, 2, 594–604. [CrossRef] [PubMed]
51. Kasai, H. Analysis of a form of oxidative DNA damage, 8-hydroxy-2t-deoxyguanosine, as a marker of cellular oxidative stress during carcinogenesis. Mutat. Res. 1997, 387, 147–163. [CrossRef]
52. Toyokuni, S.; Mori, T.; Dizdaroglu, M. DNA base modifications in renal chromatin of Wister rats treated with a renal carcinogen, ferric nitrilotriacetate. Int. J. Cancer 1994, 57, 123–128. [CrossRef]
53. Tsukahara, H.; Hiraoka, M.; Kobata, R.; Hata, I.; Ohshima, Y.; Jiang, M.Z.; Noiri, E.; Mayumi, M. Increased oxidative stress in rats with chronic nitric oxide depletion: Measurement of urinary 8-hydroxy-2t-deoxyguanosine excretion. Redox Rep. 2000, 5, 23–28. [CrossRef]
54. Floyd, R.A. The role of 8-hydroxyguanine in carcinogenesis. Carcinogenesis 1990, 11, 1447–1450. [CrossRef] [PubMed]
55. Hirano, S.-i.; Ichikawa, Y.; Sato, B.; Yamamoto, H.; Takefuji, Y.; Satoh, F. Molecular hydrogen as a potential clinically applicable radioprotective agent. Int. J. Mol. Sci. 2021, 22, 4566. [CrossRef]
56. Harris, S.L.; Levine, A.J. The p53 pathway: Positive and negative feedback loops. Oncogene 2005, 24, 2899–2908. [CrossRef] [PubMed]
57. Hasty, P.; Christy, B.A. p53 as an intervention target for cancer and aging. Pathobiol. Aging Age Relat. Dis. 2013, 3, 22702. [CrossRef]
58. Leonhardt, H.; Cardoso, M.C. DNA methylation, nuclear structure, gene expression and cancer. J. Cell Biochem. Suppl. 2000, 79
(Suppl. 35), 78–83. [CrossRef]
59. U.S. National Library of Medicine. Available online: https://clinicaltrials.gov/ct2/home (accessed on 2 July 2021).
60. Hirano, S.-i.; Ichikawa, Y.; Sato, B.; Yamamoto, H.; Takefuji, Y.; Satoh, F. Potential therapeutic applications of hydrogen in chronic inflammatory disease: Possible inhibiting role on mitochondrial stress. Int. J. Mol. Sci. 2021, 22, 2549. [CrossRef] [PubMed]
61. World Cancer Research Fund International. The Third Expert Report. 2018. Available online: https://www.wcrf.org/sites/ default/files/Summary-of-Third-Expert-Report-2018.pdf (accessed on 2 July 2021).
62. Mantovani, A.; Allavena, P.; Sica, A.; Balkwill, F. Cancer-related inflammation. Nature 2008, 454, 436–444. [CrossRef]
63. Greider, C.W. Cellular responses to telomere shortening: Cellular senescence as a tumor suppressor mechanism. Harvey Lect.
2000, 96, 33–50. [PubMed]
64. Lundberg, A.S.; Hahn, W.C.; Gupta, P.; Weinberg, R.A. Genes involved in senescence and immortalization. Curr. Opin. Cell Biol.
2000, 12, 705–709. [CrossRef]
65. Chambers, C.R.; Ritchie, S.; Pereira, B.A.; Timpson, P. Overcoming the senescence-associated secretory phenotype (SASP): A complex mechanism of resistance in the treatment of cancer. Mol. Oncol. 2021, online ahead of print. [CrossRef] [PubMed]
66. Kamimura, N.; Ichimiya, H.; Iuchi, K.; Ohta, S. Molecular hydrogen stimulates the gene expression of transcriptional coactivator PGC-1α to enhance fatty acid metabolism. NPJ Aging Mech. Dis. 2016, 2, 16008. [CrossRef] [PubMed]
67. Radiation Chemistry Data Center; Notre Dame Radiation Laboratory (n.d.). NERL Data. 2011. Available online: http://kinetics. nist.gov/solution/ (accessed on 5 August 2021).
68. Wood, K.C.; Gladwin, M.T. The hydrogen highway to reperfusion therapy. Nat. Med. 2007, 13, 673–674. [CrossRef] [PubMed]
69. Hoovis, M.L. Response of endometrial stromal sarcoma to cyclophosphamide. Am. J. Obstet. Gynecol. 1970, 108, 1117–1119. [CrossRef]
70. Kim, R.; Nishimoto, N.; Inoue, H.; Yoshida, K.; Toge, T. An analysis of the therapeutic efficacy of protracted infusion of low-dose 5-fluorouracil and cisplatin in advanced gastric cancer. J. Infect. Chemother. 2000, 6, 222–228. [CrossRef] [PubMed]
71. Levine, M. Epirubicin in breast cancer: Present and future. Clin. Breast Cancer 2000, S62–S67. [CrossRef]
72. Sekine, I.; Saijo, N. Novel combination chemotherapy in the treatment of non-small cancer lung cancer. Expert Opin. Pharmacother.
2000, 1, 1131–1161. [CrossRef]
73. Hirano, S.-i.; Agata, N.; Hara, Y.; Iguchi, H.; Shirai, M.; Tone, H.; Urakawa, N. Effects of pirarubicin, an antitumor antibiotic, on the cardiovascular system. Cancer Chemother. Pharmacol. 1991, 28, 266–272.
74. Hirano, S.-i.; Agata, N.; Hara, Y.; Iguchi, H.; Shirai, M.; Tone, H.; Urakawa, N. Pirarubicin-induced endotherium-dependent relaxation in the rat isolated aorta. J. Pharm. Pharmacol. 1991, 43, 848–854. [CrossRef]
75. Hirano, S.-i.; Agata, N.; Hara, Y.; Iguchi, H.; Shirai, M.; Tone, H.; Urakawa, N. A possible mechanism of endothelium-dependent relaxation induced by pirarubicin and carbachol in rat isolated aorta. J. Pharm. Pharmacol. 1992, 44, 244–249. [CrossRef] [PubMed]
76. Hirano, S.-i.; Agata, N.; Iguchi, H.; Tone, H. Effects of pirarubicin in comparison with epirubicin and doxorubicin on the contractile function in rat isolated cardiac muscles. Gen. Pharmacol. 1995, 26, 1339–1347. [CrossRef]
77. Rochette, L.; Zeller, M.; Cottin, Y.; Vergely, C. Antitumor activity of protons and molecular hydrogen underlying mechanism.
Cancer 2021, 13, 893. [CrossRef] [PubMed]
78. Yang, Y.; Zhu, Y.; Xi, X. Anti-inflammatory and antitumor action of hydrogen via reactive oxygen species. Oncol. Lett. 2018, 16, 2771–2776. [CrossRef]
79. Klein, E.A.; Thompson, I.M.; Tangen, C.M.; Growley, J.J.; Lucia, M.S.; Goodman, P.J.; Minasian, L.M.; Ford, L.G.; Parnes, H.L.; Gaziano, J.M.; et al. Vitamin E and the risk of prostate cancer. The selenium and vitamin E cancer prevention trial (Select). J. Am. Med. Assoc. 2011, 306, 1549–1556. [CrossRef]
80. Chandel, N.S.; Tuveson, D.A. The promise and perils of antioxidants for cancer patients. N. Engl. J. Med. 2014, 371, 177–178. [CrossRef]
81. Sayin, V.I.; Ibrahim, M.X.; Larsson, E.; Nilsson, J.A.; Lindahl, P.; Bergo, M.O. Antioxidants accelerate lung progression in mice. Sci. Transl. Med. 2014, 6, 221ra15. [CrossRef]
82. DeNicola, G.M.; Karreth, F.A.; Humpton, T.J.; Gopinathan, A.; Wei, C.; Frese, K.; Mangal, D.; Yu, K.H.; Yeo, C.J.; Calhoun, E.S.; et al. Oncogene-induced Nrf2 transcription promotes ROS detoxification and tumorigenesis. Nature 2011, 475, 106–109. [CrossRef]
83. Schafer, Z.T.; Grassian, A.R.; Song, L.; Jiang, Z.; Gerhart-Hines, Z.; Irie, H.Y.; Gao, S.; Puigserver, P.; Brugge, J.S. Antioxidant and oncogene rescue of metabolic defects caused by loss of matrix attachment. Nature 2009, 461, 109–113. [CrossRef]
84. Yang, Y.; Li, B.; Liu, C.; Chuai, Y.; Lei, J.; Gao, F.; Cui, J.; Sun, D.; Cheng, Y.; Zhou, C.; et al. Hydrogen-rich saline protects immunocytes from radiation-induced apoptosis. Med. Sci. Monit. 2012, 18, BR144–BR148. [CrossRef]
85. Zhao, S.; Yang, Y.; Liu, W.; Xuan, Z.; Wu, S.; Yu, S.; Mei, K.; Huang, Y.; Zhang, P.; Cai, J.; et al. Protective effect of hydrogen-rich saline against radiation-induced immune dysfunction. J. Cell Mol. Med. 2014, 18, 938–946. [CrossRef]
86. Ozeki, N.; Yamawaki-Ogata, A.; Narita, Y.; Mii, S.; Ushida, K.; Ito, M.; Hirano, S.-i.; Kurokawa, R.; Ohno, K.; Usui, A. Hydrogen water alleviates obliterative airway disease in mice. Gen. Thorac. Cardiovasc. Surg. 2019, 68, 158–163. [CrossRef] [PubMed]
87. Liu, C.; Kurokawa, R.; Fujino, M.; Hirano, S.-I.; Sato, B.; Li, X.K. Estimation of the hydrogen concentration in rat tissue using an airtight tube following the administration of hydrogen via various routes. Sci. Rep. 2014, 4, 5485. [CrossRef] [PubMed]
88. Yamamoto, R.; Homma, K.; Suzuki, S.; Sano, M.; Sasaki, J. Hydrogen gas distribution in organs after inhalation: Real-time monitoring of tissue hydrogen concentration in rat. Sci. Rep. 2019, 9, 1255. [CrossRef] [PubMed]


