Antitumoraktivität von Protonen und molekularem Wasserstoff: zugrunde liegende Mechanismen
Französische Arbeit über die Wirkungsweise des molekularen Wasserstoffs bei KKrebserkrankungen
PEC2 (EA7460), Fakultät für Gesundheitswissenschaften, Universität Bourgogne-Franche Comte, 7 Bd Jeanne d'Arc, 21000 Dijon, Frankreich2
Abteilung für Kardiologie, Universitätsklinikum Dijon, 21000 Dijon, Frankreich
Krebserkrankungen 2021
Einfache Zusammenstellung
Protonen (H + ) und molekularer Wasserstoff (H 2 ) in der Zelle sind für eine Vielzahl von Prozessen von entscheidender Bedeutung. Neue Krebsbehandlungen verwenden H 2 , ein biologisch inaktives Gas. H 2 kann Zellmembranen schnell durchdringen und subzelluläre Komponenten erreichen, um Kern-DNA und Mitochondrien zu schützen. H 2 reduziert oxidativen Stress, übt entzündungshemmende Wirkungen aus und wirkt als Modulator der Apoptose. Exogenes H 2 ist eine Schutztherapie, die bei Krebs eingesetzt werden kann. Zur Protonenerzeugung werden derzeit Zyklotrons und Synchrotrons eingesetzt. Die Protonenstrahl-Strahlentherapie (PBT) ist vielversprechend für die Behandlung einer Vielzahl von Krebsarten. H 2 und verschiedene Arten von H 2Spender könnten eine neuartige Therapiestrategie in der Krebsbehandlung darstellen.
Abstrakt
Das Verständnis der Struktur und Dynamik der verschiedenen Wasserstoffformen war Gegenstand zahlreicher Studien. Protonen (H + ) und molekularer Wasserstoff (H 2 ) in der Zelle sind für eine Vielzahl von Prozessen von entscheidender Bedeutung. Eine neue Krebsbehandlung nutzt H 2 , ein biologisch inaktives Gas. Aufgrund seines geringen Molekulargewichts kann H 2 schnell Zellmembranen durchdringen und subzelluläre Komponenten erreichen, um Kern-DNA und Mitochondrien zu schützen. H 2 reduziert oxidativen Stress, übt entzündungshemmende Wirkungen aus und wirkt als Modulator der Apoptose. Exogenes H 2 , verabreicht durch Inhalation, Trinken von H 2 -reichem Wasser oder Injektion von H 2-reiche Kochsalzlösung ist eine Schutztherapie, die bei zahlreichen Krankheiten, einschließlich Krebs, eingesetzt werden kann. In der Teilchentherapie werden derzeit Zyklotrone und Synchrotrone als Beschleuniger zur Erzeugung von Protonen eingesetzt. Die Protonenstrahl-Strahlentherapie (PBT) ist aufgrund der starken Verringerung der Strahlendosis an einem definierten Punkt vielversprechend für die Behandlung einer Vielzahl von Krebsarten. Unter diesen Bedingungen könnten H 2 und verschiedene Arten von H 2- Donoren eine neue Therapiestrategie bei der Krebsbehandlung darstellen.
Schlüsselwörter:
molekularer Wasserstoff ; Antioxidans ; Krebs
1. Einleitung
Oxidation und Reduktion sind allgegenwärtige Reaktionen, die in der Chemie aerober Organismen eine Schlüsselrolle spielen. Störungen im zellulären Redoxgleichgewicht werden mit Pro-Aging-Mechanismen und einem erhöhten Risiko für Krankheiten wie Krebs in Verbindung gebracht. Eine Verschiebung des Gleichgewichts zwischen Oxidationsmitteln und Antioxidantien zugunsten von Oxidationsmitteln wird als „oxidativer Stress“ bezeichnet. Oxidativer Stress (OS) ist eine Abweichung vom stabilen Redoxzustand und weist auf ein Ungleichgewicht aufgrund übermäßiger Mengen an reaktiven Sauerstoffspezies (ROS) oder Oxidationsmitteln hin, die die Fähigkeit der Zelle, eine effiziente antioxidative Reaktion bereitzustellen, übersteigen [ 1]. Die Fehlregulation des zellulären pH-Werts ist ein bekanntes Merkmal maligner Erkrankungen. Sowohl der Wasserstofftransport als auch der zytoplasmatische pH-Wert spielen eine entscheidende Rolle bei der Steuerung des Zellwachstums und der Zellproliferation sowie der Tumorentstehung. In der Zelle sind Protonen (H + ) und molekularer Wasserstoff (H 2 ) für eine Vielzahl von Prozessen von entscheidender Bedeutung. Kürzlich wurde H 2 in präklinischen und klinischen Studien zu verschiedenen Krankheiten untersucht, die mit oxidativem und entzündlichem Stress verbunden sind. In diesem Zusammenhang besteht großes Interesse an H 2 und H + als mögliche Therapieansätze bei Krebs. Dieser Aufsatz beschreibt die Rolle von H 2 und H +in Bezug auf OS und skizziert die potenzielle Antikrebsaktivität dieses endogenen Ions und verschiedener Arten von H 2 -Donoren.
2. Hintergrund: Die verschiedenen Formen von Sauerstoff und Wasserstoff
Die Struktur und Dynamik der verschiedenen Formen von Wasserstoff und Sauerstoff sind Gegenstand zahlreicher Studien. Wenn sich Sauerstoff mit einem anderen Element verbindet, was als Oxidation bezeichnet wird, wird mehr Energie freigesetzt als bei der Verbindung aller anderen Elemente. In der Zelle wird die Energie langsam freigesetzt.
Die Ordnungszahl von Sauerstoff im Periodensystem der Elemente beträgt 8, was bedeutet, dass ein Sauerstoffatom acht Elektronen enthält. Seine Elektronen sind in der folgenden Reihenfolge gefüllt: zwei Elektronen im ersten Orbital und sechs Elektronen im zweiten Orbital. Daher gibt es im Sauerstoffmolekül 16 Elektronen. Sauerstoff hat in seiner äußeren Hülle zwei ungepaarte Elektronen in getrennten Orbitalen. Diese elektronische Struktur macht Sauerstoff besonders anfällig für die Bildung von Radikalen. Ein freies Radikal ist jede chemische Spezies, die in ihrem äußeren Orbital ungepaarte Elektronen enthält.
Atomarer Wasserstoff (H) ist die Nummer 1 im Periodensystem der Elemente. Es besteht aus einem Proton und einem ungepaarten Elektron und ist somit ein freies Radikal. Wenn das Wasserstoffatom ein Elektron verliert, bleibt nur ein Proton übrig. Es wird zum positiv geladenen Wasserstoffion H + . H 2 ist ein Gas, das entsteht, wenn sich zwei Wasserstoffatome verbinden und zu einem Wasserstoffmolekül bestehend aus zwei Protonen und zwei Elektronen werden.
Hydroxid (OH − ), auch Hydroxylion genannt, ist kein freies Radikal. Die sequenzielle Reduktion von molekularem Sauerstoff führt zur Bildung einer Gruppe von ROS, wie dem Superoxidanion und dem Hydroxylradikal. Hydroxylradikal •OH ist die neutrale Form des Hydroxidions (OH − ) und ein hochreaktives freies Radikal. Das Superoxidanion (O 2 −• ) ist in der Zellbiologie von großer Bedeutung, da es zur Bildung von ROS führt. O 2 −• kann zu molekularem Sauerstoff (O 2 ) und Wasserstoffperoxid (H 2 O 2 ) dismutiert werden , entweder spontan oder in einer durch Superoxiddismutasen (SODs) katalysierten Reaktion. H 2 O 2wird auf mehreren Wegen in •OH umgewandelt, katalysiert durch Haber-Weiss-Reaktionen und metallkatalysiert durch Fenton-Reaktionen ( Abbildung 1 ). In Bezug auf ROS in der Biologie wurde ein Prozess einer chemischen Kettenreaktion beschrieben, der drei Phasen umfasst: Initiierung, Ausbreitung und Beendigung [ 2 ].
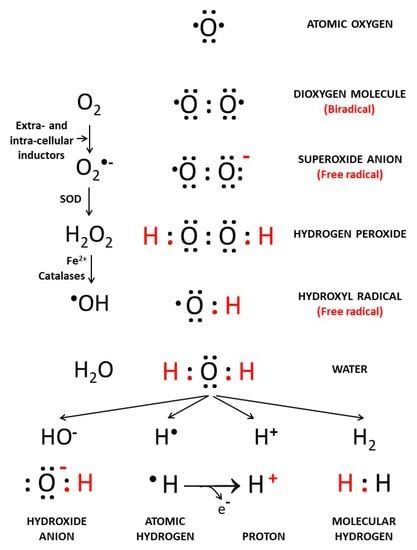
Abbildung 1. Reduktion von O 2 zu H 2 O, Zwischenprodukten freier Radikale und Wasserstoffformen. Extra- und intrazelluläre Induktionen interagieren mit atomarem Sauerstoff (O 2 ), um die Bildung freier Radikalderivate wie Superoxid (O 2 −• ), Wasserstoffperoxid (H 2 O 2 ) und das hochreaktive Hydroxylradikal (•OH) zu fördern ).
Protonen (H + ) und Hydroxidionen (OH − ) in der Zelle sind für eine Vielzahl biologischer Prozesse von entscheidender Bedeutung. Der Protonentransport durch die Plasmamembran ist für die Aufrechterhaltung des pH-Werts von zentraler Bedeutung. Zellen halten den intrazellulären pH-Wert (pHi) in einem engen Bereich (7,1–7,2), indem sie Membranprotonenpumpen und -transporter steuern [ 3 ]. Der normale physiologische pH-Wert des arteriellen Blutes von Säugetieren wird bei 7,40 ± 0,05 gehalten, was teilweise von mehreren pH-Puffersystemen wie Albumin abhängt. Eine Azidose der Körperflüssigkeiten ist an der Pathogenese von Stoffwechselerkrankungen beteiligt. Beispielsweise tritt bei Patienten mit Diabetes mellitus eine chronische Ketoazidose aufgrund erhöhter Ketonkörperwerte im Blut auf [ 4 , 5] .]. Beim Menschen wird die Aufrechterhaltung des pH-Werts in den verschiedenen Zellkompartimenten (intrazellulär und extrazellulär) durch verschiedene Regulierungssysteme erreicht. Ionen nutzen mehrere Wege, um in die zytosolische Umgebung einzudringen. In diesem Bereich spielt das Bicarbonat-Ion (HCO 3 − ) eine grundlegende Rolle, und die Säure-Base-Homöostase mit HCO 3 − wird in verschiedenen Systemen durch verschiedene Transporter entscheidend reguliert, die ausführlich besprochen wurden [ 6 , 7 ]. Das Säure-Basen-Gleichgewicht ist ein entscheidender Faktor im Herzen, und folglich trägt ein Säure-Basen-Ungleichgewicht zu Organerkrankungen bei [ 8]. Darüber hinaus wird vermutet, dass pHi eine wesentliche Rolle im Krebsstoffwechsel spielt, wo ein umgekehrter pH-Gradient ein Kennzeichen ist, das sich in extrazellulärer Azidose und intrazellulärer Alkalisierung zeigt [ 9 ] .
3. Regulierung des pH-Werts in Krebszellen
Krebszellen innerhalb eines Tumors sind hinsichtlich ihrer Spezifitäten wie Morphologie, Zelloberflächenmarker, Proliferationskinetik und Ansprechen auf die Therapie heterogen.
Wie oben erwähnt, halten Zellen den pH-Wert in einem engen Bereich (7,1–7,2) und der physiologische pH-Wert des arteriellen Blutes wird bei genau 7,40 gehalten. Im Gegensatz dazu funktionieren Krebszellen bei alkalischen zytoplasmatischen pH-Bedingungen von mehr als 7,4 und einem extrazellulären pH-Wert von 6,7–7,1. Daher ist es wichtig zu verstehen, wie sich der Redoxzustand und der pH-Wert während des Fortschreitens des Krebses ändern, wie er verschiedene Proteine während der Proliferation aktiviert und welche Mechanismen an den Resistenzeigenschaften von Krebsarten beteiligt sind. Es gibt starke Hinweise darauf, dass Krebszellen in der Regel einem höheren OS unterliegen als normale Zellen und dass ein zusätzlicher Anstieg der Prooxidantienspiegel den Zelltod auslösen kann. In Krebszellen wurde ein Redoxparadoxon beschrieben, und Schwankungen des pH-Werts scheinen an diesem Prozess beteiligt zu sein [ 10 ].
Die saure extrazelluläre Mikroumgebung im Tumor unterstützt die Expression angiogener Faktoren. In mehreren neueren Übersichten wurden die onkogenen Folgen des Transports von H + in der Plasmamembran erörtert, und auf diesem Gebiet gab es zahlreiche grundlegende Studien, die die Rolle des endosomalen pH-Werts bei Krebsphänotypen unterstreichen. Ionentransporter und -kanäle sind an der Anpassung des endosomalen pH-Werts in den endosomalen Kompartimenten beteiligt. Intrazelluläre Mitglieder von (Na + /H + )-Austauschern (NHEs) sind eine Superfamilie, die an Tumormetastasen beteiligt ist [ 11 , 12 ]. Diese Exosomen sind wichtige Vermittler der interzellulären Kommunikation innerhalb der Organe [ 13], und sie werden reichlich von Krebszellen abgesondert. Erhöhtes intrazelluläres Ca 2+ und Veränderungen des H + -Transports sind entscheidend für das Fortschreiten des Tumors und die Metastasierung. Das Säure-Basen-Gleichgewicht wird in Krebszellen und in normalen Zellen mit einem anderen Ansatz kontrolliert [ 14 ]. Bei Krebszellen kommt es zu einer ungewöhnlichen Regulierung der Protonendynamik, die mit einer regionalen Hypoxie und einer erhöhten Glykolyse einhergeht, was zu extrazellulärer Säure und intrazellulärer Alkalität führt. Die Ansammlung von Laktat- und Protonenionen im extrazellulären Raum führt zu einer sauren Umgebung, die die Proliferation fördert [ 15 ].
Die onkogene Transformation verändert das Stoffwechselprofil der Zellen in Richtung einer Hochregulierung der Glykolyse [ 16 ]. Es wurde beschrieben, dass der allgegenwärtige Na + /H + -Austauscher sowohl bei der Tumorentstehung als auch bei Zelltodprozessen eine Schlüsselrolle spielt. Eine veränderte H + -Dynamik könnte ein universeller Mechanismus bei der Umweltkarzinogenese sein. In diesem Fall wäre die gezielte Bekämpfung von Protonentransportern eine neue Klasse potenzieller Krebsbehandlungen [ 16 ].
4. Biochemie des molekularen Wasserstoffs
H 2 diffundiert in das Zytosol und erreicht schnell den Zellkern und die Mitochondrien. Endogenes H 2 wird von enteralen Bakterien als Nebenprodukt des anaeroben Stoffwechsels im Zusammenhang mit der Fermentation von Kohlenhydraten durch die residente enterobakterielle Flora produziert [ 17 ]. H 2 wird im Darm produziert und ist der Hauptgasmarker der Kohlenhydratgärung. Obwohl klar ist, dass es im Darm produziert wird, ist sein Vorhandensein in der ausgeatmeten Luft immer noch Gegenstand von Debatten. Ein Atemtest besteht aus der Verabreichung eines Kohlenhydrats (Lactulose oder Glucose) und der Messung der ausgeatmeten H2- Gaskonzentration über einen bestimmten Zeitraum [ 18 ]. Ein weiterer Weg für bakterielles H 2Bei der Produktion handelt es sich um die Spaltung von Pyruvat in Formiat im menschlichen Darm, dieser Weg wurde jedoch noch nicht nachgewiesen [ 19 ]. Hydrogenasen nutzen entweder H 2 als Substrat oder produzieren H 2 durch die Reduktion von Protonen durch die Reaktion: 2H + + 2e − ⇌ H 2 .
Die Mikroorganismen produzieren H 2 über die Wassergas-Shift-Reaktion mit Kohlenmonoxid (CO): CO + H 2 O → CO 2 + H 2 . Einige photosynthetische Bakterien sind insofern einzigartig, als sie über einen Kohlenmonoxid (CO)-Oxidationsweg verfügen, der CO und H 2 O in H 2 und CO 2 umwandelt . Bei der biologisch vermittelten Reaktion oxidiert eine Kohlenmonoxid-Dehydrogenase (CODH) CO und es werden Elektronen freigesetzt. Anschließend reduziert die gekoppelte Hydrogenase die freigesetzten Elektronen zu H 2 [ 20]. CO wird endogen von glatten Gefäßmuskelzellen (SMCs) unter Hypoxiebedingungen produziert und kann dann die cGMP-Spiegel sowohl in Endothelzellen als auch in SMCs modulieren [ 5 , 21 ].
5. Antioxidative und entzündungshemmende Eigenschaften von H 2
Für die Wasserstoffverabreichung gibt es drei Methoden: das Einatmen von Wasserstoffgas, das Trinken von wasserstoffreichem Wasser oder die Injektion von wasserstoffreicher Kochsalzlösung ( Abbildung 2 ).
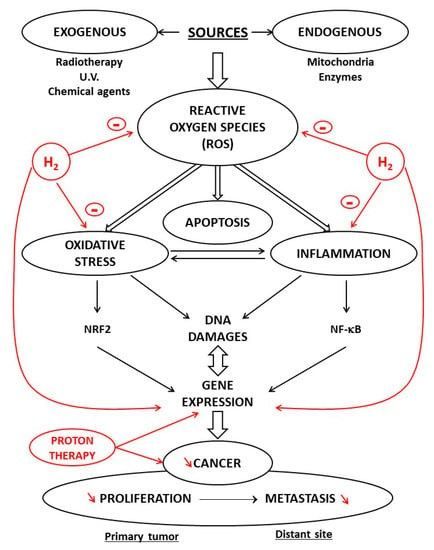
Die meisten Studien basieren auf Tiermodellen, die eine Grundlage für die klinische Anwendung von H 2 bilden . Der Grund für die Verwendung von H 2 in der klinischen Medizin hängt mit seinen antioxidativen und entzündungshemmenden Eigenschaften zusammen [ 22 ]. Abhängig von ihrer Reaktivität und Lokalisierung sind ROS an physiologischen und pathophysiologischen Prozessen beteiligt, und OS ist an der Auslösung und Entwicklung von Entzündungen beteiligt [ 4 ]. Zahlreiche Rezensionen in der Literatur haben den Zusammenhang zwischen OS und Entzündung sowie die Bedeutung der gezielten Steuerung der NRF2/Antioxidans-Signalisierung und der NF-κB-Entzündungsreaktion dokumentiert. Es wird nun angenommen, dass H 2 diese Parameter beeinflusst [ 23 ].
Bei der Neuprogrammierung des Tumorstoffwechsels werden ROS erzeugt und die antioxidativen Systeme aktiviert. Hohe Mengen an ROS führen zu oxidativen Schäden und sogar zum Zelltod, wohingegen ROS in niedrigen Mengen als zweiter Botenstoff fungieren und viele Signalwege im Zusammenhang mit der Entwicklung der Zellen regulieren, was zu Veränderungen der Proteinkonformation und -funktion führt. Erhöhte ROS-Werte wurden in den meisten Krebszelllinien gefunden und stehen im Zusammenhang mit dem Fortschreiten der Krankheit und der Resistenz gegen die Behandlung [ 24 ]. Fast allen Tumorzellen ist ein erhöhter ROS-Spiegel gemeinsam, und dies wurde als mögliches gemeinsames Ziel für therapeutische Ansätze vorgeschlagen [ 25] .]. In den letzten Jahren haben neue Wirkstoffe mit spezifischen antioxidativen Funktionen aufgrund ihrer Fähigkeit, die ROS-Bildung und die Krebsentstehung zu reduzieren, große Aufmerksamkeit als potenzielle Therapien auf sich gezogen [ 26 ]. Unter diesen Schutzmitteln hat H 2 einzigartige Eigenschaften. Es trägt zur antioxidativen Abwehr in der Zelle bei, da es das Hydroxylradikal abfängt, das die zytotoxischste ROS darstellt. Mit der Methode des Spin-Trapping durch 5,5-Dimethyl-1-pyrrolin-N-oxid (DMPO) wurde gezeigt, dass H 2 in einem zellfreien System direkt mit Hydroxylradikalen reagiert und diese in Zellkulturen reduziert [ 27 ]. H 2verringerte die von NADPH-Oxidase (NOX) abgeleiteten freien Radikale, die während der Phagozytose entstehen, wobei NADPH-Oxidase ein wichtiges prooxidatives Enzym ist [ 28 ]. H 2 senkt das OS sowohl direkt als auch durch die Induktion antioxidativer Enzyme wie Superoxidoxidase (SOD) und Myeloperoxidase [ 29 ].
Durch welche Mechanismen ist H 2 ein Antioxidans? Antioxidative Moleküle können direkt mit reaktiven Radikalen reagieren und diese zerstören. Bei der Bewertung des antioxidativen Potenzials einer Verbindung müssen viele Kriterien berücksichtigt werden, beispielsweise eine Wirkung auf die Chelatbildung von Übergangsmetallen [ 30 ]. Spezifische antioxidative Mechanismen begrenzen oxidative Schäden, aber unter bestimmten Bedingungen können Oxidationsmittel prooxidative Wirkungen haben. Einige Wirkstoffe wirken als Antioxidantien und sind aufgrund ihrer wasserstoffspendenden Fähigkeit in der Lage, freie Radikale abzufangen [ 31 ]. Die Prozesse, die den verschiedenen Wirkungen von H 2 zugrunde liegen , wurden untersucht und es wurde nachgewiesen, dass H 2Obwohl es ROS abbaut, kann es die Abwehrmechanismen und die Aktivität des Immunsystems beeinträchtigen. Die beobachteten Aktivitäten von H 2 waren dosisabhängig und erschienen in einigen Fällen Fällen inkonsistent oder sogar paradox [ 32 ].
6. Wasserstoff-Paradoxon: Antioxidans und/oder Prooxidans
Das scheinbare Paradoxon zwischen den schützenden und toxischen Wirkungen von H 2 wird durch experimentelle und klinische Beweise gestützt. Dieses Paradoxon wurde für eine Reihe von Antioxidantienverbindungen beschrieben. Melatonin ist ein gut dokumentiertes Antioxidans; Melatonin verstärkt jedoch die ROS-Bildung in einem Redoxsystem mit geringen Kupferkonzentrationen aufgrund der Reduktion von Kupfer(II)-Ionen zu Kupfer(I)-Ionen durch Melatonin [ 33 ]. Dieses Paradox wurde auch bei Vitaminen wie Ascorbinsäure (Vitamin C) nachgewiesen. Ascorbinsäure hat zahlreiche antioxidative Eigenschaften, kann aber in vitro prooxidative Wirkungen entfalten, meist durch Wechselwirkung mit Übergangsmetallionen [ 34] .]. Übergangsmetallionen sind Schlüsselelemente für verschiedene biologische Prozesse, und ihre Homöostase wird durch streng regulierte Mechanismen, Redox- und Nicht-Redoxmetall-induzierte Bildung freier Radikale und ihre Rolle bei menschlichen Krankheiten in engen Grenzen aufrechterhalten [35 ] .
Die Beziehungen zwischen H 2 -Transportern und Übergangsmetallionen sind komplex. Biologische Studien legen nahe, dass die Metallionen Enzyme wie Transhydrogenase beeinflussen, indem sie an eine Stelle im Protonentransferweg binden. Die Hemmung von Protonentransferschritten durch Metallionen wie Zn 2+ wurde in Studien an einer Reihe von Membranproteinen wie NADH-Dehydrogenase und Cytochromoxidase beschrieben [ 36 , 37 ].
7. Protonenstrahlentherapie und Antitumoraktivität
Neue Behandlungen, die auf dem Wasserstoffstoffwechsel basieren, scheinen eine selektive Hemmung von Krebszellen zu ermöglichen. So gibt es Hinweise darauf, dass neue Strahlentherapieverfahren eine selektive Hemmung von Krebszellen bewirken. In der Teilchentherapie werden derzeit Zyklotrone und Synchrotrone als Beschleuniger eingesetzt. Der Hauptbestandteil eines typischen Zyklotrons für die Therapie ist eine Protonenquelle im Zentrum des Zyklotrons, in der Wasserstoffgas ionisiert und aus der die Protonen extrahiert werden. Protonen sind schwere, positiv geladene Teilchen, die aus Wasserstoffgas herausgelöst und mit einem Beschleuniger auf Lichtgeschwindigkeit beschleunigt werden können [ 22]. Die Protonenstrahl-Strahlentherapie (PBT) ist vielversprechend für die Behandlung einer Vielzahl von Krebsarten, da die Strahlendosis an einem definierten Punkt, dem sogenannten Bragg-Peak, stark abnimmt [ 38 ] . PBT ist eine fortschrittliche Form der Strahlentherapie, bei der die Strahlenbehandlung durch beschleunigte Protonenstrahlen und nicht durch Röntgenstrahlen erfolgt. Ein Protonenstrahl gibt beim Erreichen des Tumors etwas Strahlung an gesundes Gewebe ab, über den Rand des zu behandelnden Tumors hinaus jedoch nur sehr wenig Strahlung. Dies bedeutet, dass PBT Krebserkrankungen genauso effektiv behandeln kann, jedoch weniger Strahlung auf andere gesunde Körperteile, die den Tumor umgeben, abgibt. Um eine Wirkung auf Krebszellen zu erzielen, werden die Photonen beschleunigt.
Wie alle geladenen Teilchen erleiden Protonen auf den letzten Millimetern des Eindringens einen sehr schnellen Energieverlust. Diese geladenen Teilchen schädigen die DNA von Zellen und töten sie letztendlich ab. Kernreaktionen stehen hauptsächlich im Mittelpunkt der klinischen Protonentherapie und der Protonentherapieforschung [ 39 ]. Protonen können über Kernreaktionen mit dem Atomkern interagieren und Veränderungen hervorrufen [ 40 ]. Protonen können Störungen der Genexpression, Veränderungen der Signalübertragung und Funktion im Zellzyklus, Invasion und Angiogenese hervorrufen und bei Krebs die fortschreitenden Prozesse der Invasion und Migration hemmen [41] .]. Die physikalischen Eigenschaften der Protonentherapie haben Vorteile gegenüber der Photonenbehandlung, und das klinische Verfahren der Protonentherapie bei Krebs hat aufgrund der dosimetrischen Vorteile von Protonen erheblich zugenommen [ 42 ]. Protonen werden mit zwei verschiedenen Strahlungstechniken abgegeben: der passiven Streuprotonentherapie (PSPT) oder der Pencil-Beam-Scanning-Technik (PBS). Bei der PSPT wird der gesamte Tumor bestrahlt, wobei Kollimatoren und Kompensatoren zur Anpassung der Dosis verwendet werden. Bei der PBS wird das Zielvolumen Punkt für Punkt mit einem schmalen Protonenstrahl abgetastet [ 43 ].
8. Schutzeigenschaften von molekularem Wasserstoff: potentielles Antitumormittel
Wie oben beschrieben, zeigt H 2als Modulator der Apoptose Antikrebsaktivität und therapeutische Wirkungen bei hämatologischen Erkrankungen. Im Gegenteil führt ionisierende Strahlung nach einer Krebsbestrahlung, insbesondere im Herzen, zu einer Schädigung des normalen Gewebes [ 44 ]. Diese radiotoxischen Wirkungen stehen hauptsächlich im Zusammenhang mit der Produktion von ROS, die verschiedene Zellen schädigen. Da H 2 die ROS-Produktion verringern kann, kann die H 2 -Therapie eine wirksame Behandlung des akuten Strahlensyndroms sein [ 45 ]. Darüber hinaus ist H 2 ein Schutzmittel beim Strahlenschutz strahlenempfindlicher Gewebe, beispielsweise bei Hautkrebs [ 46]. Der Einsatz eines Überdruckverfahrens hat auch bei verschiedenen Krebsinterventionen positive Auswirkungen gezeigt. Aktuelle Daten belegen die Gültigkeit der Verwendung von hyperbarem Sauerstoff und hyperbarem H 2 bei der Behandlung von Malignomen [ 47 ].
Im klinischen Kontext besteht ein Bedarf an Chemotherapeutika ohne schwerwiegende Nebenwirkungen. Eines dieser Chemotherapeutika ist Cisplatin, das zur Behandlung verschiedener Tumoren eingesetzt wird. Allerdings ist die Hochdosistherapie durch nephrotoxische Wirkungen begrenzt [ 48 ]. Cisplatin stimuliert die Bildung von ROS und die renale Lipidperoxidation. Die mit Cisplatin verbundenen Toxizitäten führen teilweise zur Produktion von ROS, was zu Organschäden führen kann. Daher wurde versucht, die schützende Wirkung von Wirkstoffen mit antioxidativen Eigenschaften auf Cisplatin-induzierte Nebenwirkungen, insbesondere Nephrotoxizität, zu ermitteln [ 49 ]. H 2 hat in experimentellen Studien eine mögliche Schutzwirkung gezeigt: das Einatmen von H 2 -Gas und das Trinken von H 2Wasser verbesserte die Mortalität und den Gewichtsverlust, die durch die Behandlung mit Cisplatin verursacht wurden, und begrenzte die Nephrotoxizität bei Mäusen, ohne die Antitumoraktivität zu beeinträchtigen [ 50 ].
In jüngerer Zeit hat die Strahlenbehandlung von Lebertumoren gezeigt, dass das Trinken von wasserstoffreichem Wasser positive Auswirkungen auf die Parameter der Lebensqualität haben kann. H2 - Wasser verhinderte Appetitlosigkeit, ohne die Tumorreaktion auf die Strahlentherapie zu verändern [ 51 ].
Zum Thema des durch H 2 induzierten Organschutzes untersuchte eine Schlüsselstudie den möglichen Prozess, der an der präventiven Wirkung von wasserstoffreicher Kochsalzlösung auf die Toxizität von Doxorubicin (DOX) beteiligt ist. Die Verwendung von DOX ist aufgrund seiner Zytotoxizität in Organen wie Herz und Leber begrenzt [ 52 ]. In einem Doxorubicin-Rattenmodell wurde gezeigt, dass eine Behandlung mit wasserstoffreicher Kochsalzlösung den entzündlichen TNF-α/IL-6-Weg hemmen und die Zellapoptose in Organen wie Herz und Leber abschwächen kann [ 53 ] .
Was bösartige Tumoren betrifft, deuten Studien darauf hin, dass diese Tumoren als abnormales Gewebe angesehen werden können, das Krebsstammzellen (CSCs) enthält. CSCs sind eine Untergruppe von Zellen innerhalb von Tumoren. Sie können sich selbst erneuern und Vorläuferzellen differenzierterer Krebszellen produzieren und sind an der Entwicklung verschiedener Tumoreigenschaften mit potenziellen neuen gezielten Therapien beteiligt [ 54 ]. Bei Mäusen scheint H 2 -reiches Wasser die Entwicklung der bei Mäusen induzierten Hepatokarzinogenese zu verhindern. Es wurde vermutet, dass diese positiven Ergebnisse teilweise auf eine Verringerung der CSCs zurückzuführen waren [ 55 ]
Aktuelle experimentelle Ergebnisse deuten darauf hin, dass H 2 ein Antitumormittel bei der Behandlung von Glioblastomen ist. Die invasiven Eigenschaften des Glioblastoms stellen ein zentrales Problem für eine kurative Behandlung dar, wenn eine chirurgische Resektion nicht durchführbar ist. Die experimentellen In-vivo-Studien zeigten, dass die H2 - Inhalation das Wachstum von Glioblastom-Tumoren unterdrücken und so das Überleben von Mäusen mit Glioblastom verlängern kann [ 56 ]. In einer aktuellen Studie zeigen Daten, dass bei einem Patienten, bei dem Lungenkrebs mit Metastasen diagnostiziert wurde, die H2- Gas -Monotherapie mit einer signifikant wirksamen Tumorkontrolle verbunden war [ 57 ]. Das H +Die therapieassoziierte Therapie zur Behandlung maligner Gliome ist eine neue Therapiestrategie. In diesem Zusammenhang führt die Hemmung des Natrium/Wasserstoff-Austauschers 1 (NHE1) in Gliomen zu einer Ansäuerung von Tumorzellen, während normale Gehirnzellen nicht betroffen sind, was eine neue Perspektive für die Behandlung dieser bösartigen Hirntumoren bietet [ 58 ] .
Bei Hautalterung und Hautkrebs deuten aktuelle Erkenntnisse darauf hin, dass einige Wirkstoffe durch antioxidative Aktivität Schutz vor durch UV-Strahlung verursachten Hautschäden bieten können [ 59 ]. Die Anwendung von H 2 -verstärktem Wasser verhinderte die UV-induzierte ROS-Produktion und inhibierte proinflammatorische Zytokin-mRNAs für Interleukin-6 und Interleukin-1β [ 60 ]. Unter diesen Bedingungen der H 2 -angereicherten Wasseraufbereitung war die Typ-1-Kollagensynthese in den Proben im Vergleich zu den Kontrollen erhöht [ 61 ]. Eine kürzlich durchgeführte Studie berichtete, dass das Trinken von mit H 2 angereichertem Wasser das Volumen und das Gewicht von Endometriumtumoren in einem Xenotransplantat-Mausmodell, H 2 , reduzierteInduktion von Pyroptose, einem entzündlichen programmierten Zelltodprozess, über ROS/NLRP3/Caspase-1-Wege. Diese Studie zeigte, dass mit H 2 stimulierte Endometriumzellen zu einer zellulären NLRP3-Aktivierung führen können [ 62 ]. Die Rolle von ROS in klinischen Situationen ist jedoch nicht klar, da sie sowohl tumorfördernde als auch tumorsupprimierende Funktionen haben [ 63 ].
Unter dem Gesichtspunkt der Tumorförderung und -unterdrückung haben Studien darauf hingewiesen, dass es eine Wechselwirkung zwischen den Regulationsmechanismen von H 2 bei Krebs, Apoptose und Autophagie gibt. In der Krebsbiologie spielt Autophagie eine doppelte Rolle bei der Tumorförderung und -unterdrückung und trägt zur Entwicklung und Proliferation von Krebszellen bei [ 64 ]. H 2 spielt eine schützende Rolle, indem es die Autophagie bei mehreren Krankheiten, einschließlich Krebs, moduliert. H 2 mildert Lungenschäden, indem es die Autophagie in den Alveolarepithelzellen septischer Ratten durch die Hemmung des p38-MAPK-Signalwegs hemmt [ 65 ]. Einige dieser neueren Studien zu Verletzungsmodellen bleiben jedoch umstritten und weitere Forschung ist erforderlich.
Schlussfolgerungen
Zusammenfassend lässt sich sagen, dass H 2 präventive und therapeutische Wirkungen gezeigt hat. Eine Vorbehandlung mit H 2 ist wirksamer als eine Nachbehandlung [ 66 ]. H 2 reduziert oxidativen Stress, übt entzündungshemmende Wirkungen aus und wirkt als Modulator der Apoptose [ 67 ]. Neben der direkten Wirkung des •OH-Fängers werden die biologischen Wirkungen von H 2 auf die Modulation der Signaltransduktion und Veränderungen der Genexpression zurückgeführt. Viele der zellulären Mechanismen bei der H2 - Therapie bleiben unklar, sicherlich weil dieses Gas mit mutmaßlichen Molekülen reagiert. Darüber hinaus wird der Zusammenhang zwischen dem mitochondrialen Energiestoffwechsel und der Verteilung von H 2 untersuchtist noch nicht vollständig geklärt [ 68 ]. Die größten Vorteile der Verwendung von H 2 sind seine Fähigkeit, biologische Membranen zu durchdringen und die mit seiner Verwendung verbundenen geringfügigen nachteiligen Auswirkungen. Unter diesen Bedingungen können H 2 und verschiedene Arten von H 2- Donoren [ 69 ] neue Therapiestrategien in der Krebsbehandlung darstellen.
Finanzierung
Diese Arbeit wurde durch Zuschüsse des französischen Forschungsministeriums sowie des Regionalrats von Burgund und Franche-Comté, FEDER und der Association de Cardiologie de Bourgogne unterstützt.
Danksagungen
Die Autoren danken Suzanne Rankin für die englische Unterstützung.
Interessenskonflikte
Die Autoren geben an, dass kein Interessenkonflikt besteht.
Verweise
1. Sies, H. Oxidativer Stress: Ein Konzept in der Redoxbiologie und Medizin. Redox-Biol. 2015 , 4 , 180–183. [ Google Scholar ] [ CrossRef ][ Grüne Version ]
2. Vergely, C.; Maupoil, V.; Clermont, G.; Bril, A.; Rochette, L. Identifizierung und Quantifizierung freier Radikale während myokardialer Ischämie und Reperfusion mittels paramagnetischer Elektronenresonanzspektroskopie. Bogen. Biochem. Biophys. 2003 , 420 , 209–216. [ Google Scholar ] [ CrossRef ]
3. Boedtkjer, E.; Aalkjaer, C. Intrazellulärer pH-Wert im Widerstandsgefäßsystem: Regulierung und funktionelle Auswirkungen. J. Vasc. Res. 2012 , 49 , 479–496. [ Google Scholar ] [ CrossRef ]
4. Rochette, L.; Zeller, M.; Cottin, Y.; Vergely, C. Diabetes, oxidativer Stress und therapeutische Strategien. Biochim. Et Biophys. Acta 2014 , 1840 , 2709–2729. [ Google Scholar ] [ CrossRef ]
5. Rochette, L.; Zeller, M.; Cottin, Y.; Vergely, C. Redoxfunktionen von Hämoxygenase-1 und Biliverdinreduktase bei Diabetes. Trends Endokrinol. Metab. 2018 , 29 , 74–85. [ Google Scholar ] [ CrossRef ] [ PubMed ]
6. Parker, MD; Boron, WF Die Divergenz, Wirkungen, Rollen und Verwandten natriumgekoppelter Bicarbonattransporter. Physiol. Rev. 2013 , 93 , 803–959. [ Google Scholar ] [ CrossRef ] [ PubMed ][ Grüne Version ]
7. Shcheynikov, N.; Sohn, A.; Hong, JH; Yamazaki, O.; Ohana, E.; Kurtz, I.; Shin, DM; Muallem, S. Intrazelluläres Cl- als Signalion, das Na+/HCO3--Transporter wirksam reguliert. Proz. Natl. Acad. Wissenschaft. USA 2015 , 112 , E329–E337. [ Google Scholar ] [ CrossRef ] [ PubMed ][ Grüne Version ]
8. Odunewu-Aderibigbe, A.; Fliegel, L. Der Na(+)/H(+)-Austauscher und die pH-Regulierung im Herzen. Iubmb Life 2014 , 66 , 679–685. [ Google Scholar ] [ CrossRef ]
9. Persi, E.; Duran-Frigola, M.; Damaghi, M.; Roush, WR; Aloy, P.; Cleveland, JL; Gillies, RJ; Ruppin, E. Systemanalyse intrazellulärer pH-Schwachstellen für die Krebstherapie. Nat. Komm. 2018 , 9 , 2997. [ Google Scholar ] [ CrossRef ]
10. Chaiswing, L.; St. Clair, WH; St. Clair, DK Redox-Paradoxon: Ein neuartiger Ansatz für therapieresistenten Krebs. Antioxid. Redox-Signal. 2018 , 29 , 1237–1272. [ Google Scholar ] [ CrossRef ] [ PubMed ]
11. Weiß, KA; Grillo-Hill, BK; Barber, DL Verhaltensweisen von Krebszellen, die durch eine gestörte pH-Dynamik vermittelt werden, auf einen Blick. J. Cell Sci. 2017 , 130 , 663–669. [ Google Scholar ] [ CrossRef ][ Grüne Version ]
12. Pedersen, SF; Counillon, L. Die SLC9A-C-Na(+)/H(+)-Austauscherfamilie von Säugetieren: Moleküle, Mechanismen und Physiologie. Physiol. Rev. 2019 , 99 , 2015–2113. [ Google Scholar ] [ CrossRef ]
13. Li, N.; Rochette, L.; Wu, Y.; Rosenblatt-Velin, N. Neue Einblicke in die Rolle von Exosomen im Herzen nach Myokardinfarkt. J. Cardiovasc. Übers. Res. 2019 , 12 , 18–27. [ Google Scholar ] [ CrossRef ] [ PubMed ]
14. Harguindey, S.; Alfarouk, K.; Orozco, JP; Hardonniere, K.; Stanciu, D.; Fais, S.; Devesa, J. Ein neuer und ganzheitlicher Ansatz zur Ätiopathogenese und Behandlung von Brustkrebs basierend auf seiner Wasserstoffionendynamik. Int. J. Mol. Wissenschaft. 2020 , 21 , 1110. [ Google Scholar ] [ CrossRef ] [ PubMed ][ Grüne Version ]
15. Lebelo, MT; Joubert, AM; Visagie, MH Warburg-Effekt und seine Rolle bei der Tumorentstehung. Bogen. Pharm. Res. 2019 , 42 , 833–847. [ Google Scholar ] [ CrossRef ]
16. Cardone, RA; Alfarouk, KO; Elliott, RL; Alqahtani, SS; Ahmed, SBM; Aljarbou, AN; Greco, MR; Cannone, S.; Reshkin, SJ Die Rolle des Natriumwasserstoffaustauschers 1 bei der Fehlregulation der Protonendynamik und der Neuprogrammierung des Krebsstoffwechsels als Folgeerscheinung. Int. J. Mol. Wissenschaft. 2019 , 20 , 3694. [ Google Scholar ] [ CrossRef ][ Grüne Version ]
17. Ohta, S. Molekularer Wasserstoff als präventives und therapeutisches medizinisches Gas: Initiierung, Entwicklung und Potenzial der Wasserstoffmedizin. Pharmakol. Dort. 2014 , 144 , 1–11. [ Google Scholar ] [ CrossRef ][ Grüne Version ]
18. Jahng, J.; Jung, IS; Choi, EJ; Conklin, JL; Park, H. Die Auswirkungen von Methan- und Wasserstoffgasen, die von Darmbakterien produziert werden, auf die Motilität des Ileums und die Transitzeit des Dickdarms. Neurogastroenterol. Beweglich. 2012 , 24 , 185–190.e192. [ Google Scholar ] [ CrossRef ]
19. Kalantar-Zadeh, K.; Berean, KJ; Burgell, RE; Muir, JG; Gibson, PR Darmgase: Einfluss auf Darmstörungen und die Rolle von Ernährungsumstellungen. Nat. Rev. Gastroenterol. Hepatol. 2019 , 16 , 733–747. [ Google Scholar ] [ CrossRef ]
20. Mohr, T.; Aliyu, H.; Kuchlin, R.; Polliack, S.; Zwick, M.; Neumann, A.; Cowan, D.; de Maayer, P. CO-abhängige Wasserstoffproduktion durch den fakultativ anaeroben Parageobacillus thermoglucosidasius. Mikrob. Zellfakt. 2018 , 17 , 108. [ Google Scholar ] [ CrossRef ] [ PubMed ]
21. Rochette, L.; Lorin, J.; Zeller, M.; Guilland, JC; Lorgis, L.; Cottin, Y.; Vergely, C. Hemmung der Stickoxidsynthase und oxidativer Stress bei Herz-Kreislauf-Erkrankungen: Mögliche therapeutische Ziele? Pharmakol. Dort. 2013 , 140 , 239–257. [ Google Scholar ] [ CrossRef ] [ PubMed ]
22. Schippers, JM Miniaturisierung der Protonentherapie: Eine technische Herausforderung mit unklaren klinischen Auswirkungen. Int. J. Radiat. Oncol. Biol. Physik. 2016 , 95 , 149–153. [ Google Scholar ] [ CrossRef ] [ PubMed ]
23. Nakao, A.; Sugimoto, R.; Billiar, TR; McCurry, KR Therapeutisches antioxidatives medizinisches Gas. J. Clin. Biochem. Nutr. 2009 , 44 , 1–13. [ Google Scholar ] [ CrossRef ][ Grüne Version ]
24. Panieri, E.; Santoro, MM ROS-Homöostase und Stoffwechsel: Eine gefährliche Verbindung in Krebszellen. Zelltod-Dis. 2016 , 7 , e2253. [ Google Scholar ] [ CrossRef ] [ PubMed ]
25. Benfeito, S.; Oliveira, C.; Soares, P.; Fernandes, C.; Silva, T.; Teixeira, J.; Borges, F. Antioxidative Therapie: Immer noch auf der Suche nach der „Wunderwaffe“. Mitochondrion 2013 , 13 , 427–435. [ Google Scholar ] [ CrossRef ] [ PubMed ]
26. Sosa, V.; Moline, T.; Somoza, R.; Paciucci, R.; Kondoh, H.; ME, LL Oxidativer Stress und Krebs: Ein Überblick. Alterungsres. Rev. 2013 , 12 , 376–390. [ Google Scholar ] [ CrossRef ]
27. Ohsawa, I.; Ishikawa, M.; Takahashi, K.; Watanabe, M.; Nishimaki, K.; Yamagata, K.; Katsura, K.; Katayama, Y.; Asoh, S.; Ohta, S. Wasserstoff wirkt als therapeutisches Antioxidans, indem er zytotoxische Sauerstoffradikale selektiv reduziert. Nat. Med. 2007 , 13 , 688–694. [ Google Scholar ] [ CrossRef ]
28. Wang, L.; Zhang, H.; Sun, M.; Yin, Z.; Qian, J. Durch hohe Mobilität, Gruppenbox 1, vermittelte Autophagie fördert die Chemoresistenz von Neuroblastomzellen. Oncol. Rep. 2015 , 34 , 2969–2976. [ Google Scholar ] [ CrossRef ] [ PubMed ][ Grüne Version ]
29. Tao, G.; Lied, G.; Qin, S. Molekularer Wasserstoff: Aktuelles Wissen über Mechanismen zur Linderung von Schäden und Krankheiten durch freie Radikale. Acta Biochim. Biophys. Sünde. (Shanghai) 2019 , 51 , 1189–1197. [ Google Scholar ] [ CrossRef ]
30. Rochette, L.; Ghibu, S.; Richard, C.; Zeller, M.; Cottin, Y.; Vergely, C. Direkte und indirekte antioxidative Eigenschaften von Alpha-Liponsäure und therapeutisches Potenzial. Mol. Nutr. Lebensmittelres. 2013 , 57 , 114–125. [ Google Scholar ] [ CrossRef ]
31. Pisoschi, AM; Pop, A. Die Rolle von Antioxidantien in der Chemie des oxidativen Stresses: Eine Übersicht. EUR. J. Med. Chem. 2015 , 97 , 55–74. [ Google Scholar ] [ CrossRef ]
32. Poljsak, B.; Suput, D.; Milisav, I. Erreichen des Gleichgewichts zwischen ROS und Antioxidantien: Wann sollten synthetische Antioxidantien verwendet werden? Oxid. Med. Zelllänge. 2013 , 2013 , 956792. [ Google Scholar ] [ CrossRef ] [ PubMed ]
33. Wang, J.; Wang, X.; Hey.; Jia, L.; Yang, CS; Reiter, RJ; Zhang, J. Antioxidative und prooxidative Aktivitäten von Melatonin in Gegenwart von Kupfer und Polyphenolen in vitro und in vivo. Cells 2019 , 8 , 903. [ Google Scholar ] [ CrossRef ][ Grüne Version ]
34. Du, J.; Cullen, JJ; Buettner, GR Ascorbinsäure: Chemie, Biologie und die Behandlung von Krebs. Biochim. Biophys. Acta 2012 , 1826 , 443–457. [ Google Scholar ] [ CrossRef ] [ PubMed ][ Grüne Version ]
35. Valko, M.; Jomova, K.; Rhodes, CJ; Kuca, K.; Musilek, K. Redox- und Nicht-Redoxmetall-induzierte Bildung freier Radikale und ihre Rolle bei Erkrankungen des Menschen. Bogen. Toxicol. 2016 , 90 , 1–37. [ Google Scholar ] [ CrossRef ] [ PubMed ]
36. Muramoto, K.; Hirata, K.; Shinzawa-Itoh, K.; Yoko-o, S.; Yamashita, E.; Aoyama, H.; Tsukihara, T.; Yoshikawa, S. Ein Histidinrest, der als Kontrollstelle für die Disauerstoffreduktion und das Protonenpumpen durch Cytochrom-C-Oxidase fungiert. Proz. Natl. Acad. Wissenschaft. USA 2007 , 104 , 7881–7886. [ Google Scholar ] [ CrossRef ][ Grüne Version ]
37. Whitehead, SJ; Iwaki, M.; Baumwolle, NP; Rich, PR; Jackson, JB Hemmung von Protonentransferschritten in der Transhydrogenase durch Übergangsmetallionen. Biochim. Biophys. Acta 2009 , 1787 , 1276–1288. [ Google Scholar ] [ CrossRef ][ Grüne Version ]
38. Verma, V.; Shah, C.; Rwigema, JC; Solberg, T.; Zhu, X.; Simone, CB, 2. Kostenvergleichbarkeit der Protonen- und Photonentherapie. Kinn. Klin. Oncol. 2016 , 5 , 56. [ Google Scholar ] [ CrossRef ]
39. Wroe, AJ; Cornelius, IM; Rosenfeld, AB Die Rolle nichtelastischer Reaktionen bei der Verteilung der absorbierten Dosis von therapeutischen Protonenstrahlen in verschiedenen Medien. Med. Physik. 2005 , 32 , 37–41. [ Google Scholar ] [ CrossRef ] [ PubMed ]
40. Newhauser, WD; Zhang, R. Die Physik der Protonentherapie. Physik. Med. Biol. 2015 , 60 , R155–R209. [ Google Scholar ] [ CrossRef ]
41. Girdhani, S.; Sachs, R.; Hlatky, L. Biologische Auswirkungen der Protonenstrahlung: Ein Update. Strahlen. Prot. Dosim. 2015 , 166 , 334–338. [ Google Scholar ] [ CrossRef ]
42. Weber, DC; Wang, H.; Cozzi, L.; Dipasquale, G.; Khan, HG; Ratib, O.; Rouzaud, M.; Vees, H.; Zaidi, H.; Miralbell, R. RapidArc, intensitätsmodulierte Photonen- und Protonentechniken für wiederkehrenden Prostatakrebs bei zuvor bestrahlten Patienten: Eine Vergleichsstudie zur Behandlungsplanung. Strahlen. Oncol. 2009 , 4 , 34. [ Google Scholar ] [ CrossRef ]
43. McGowan, SE; Burnet, NG; Lomax, AJ Optimierung der Behandlungsplanung in der Protonentherapie. Br. J. Radiol. 2013 , 86 , 20120288. [ Google Scholar ] [ CrossRef ][ Grüne Version ]
44. Dalloz, F.; Maingon, P.; Cottin, Y.; Briot, F.; Horiot, JC; Rochette, L. Auswirkungen einer kombinierten Bestrahlung und Doxorubicin-Behandlung auf die Herzfunktion und die antioxidative Abwehr bei der Ratte. Freies Radikal. Biol. Med. 1999 , 26 , 785–800. [ Google Scholar ] [ CrossRef ]
45. Liu, C.; Cui, J.; Sun, Q.; Cai, J. Die Wasserstofftherapie könnte eine wirksame und spezifische neuartige Behandlung des akuten Strahlensyndroms sein. Med. Hypothesen 2010 , 74 , 145–146. [ Google Scholar ] [ CrossRef ]
46. Dole, M.; Wilson, FR; Fife, WP Hyperbare Wasserstofftherapie: Eine mögliche Behandlung von Krebs. Science 1975 , 190 , 152–154. [ Google Scholar ] [ CrossRef ]
47. Stepien, K.; Ostrowski, RP; Matyja, E. Hyperbarer Sauerstoff als Zusatztherapie bei der Behandlung von bösartigen Erkrankungen, einschließlich Hirntumoren. Med. Oncol. 2016 , 33 , 101. [ Google Scholar ] [ CrossRef ] [ PubMed ][ Grüne Version ]
48. Casal, MA; Nolin, TD; Beumer, JH Einschätzung der Nierenfunktion in der Onkologie: Auswirkungen auf die Auswahl und Dosierung von Krebsmedikamenten. Klin. Marmelade. Soc. Nephrol. 2019 , 14 , 587–595. [ Google Scholar ] [ CrossRef ] [ PubMed ]
49. Hakiminia, B.; Goudarzi, A.; Moghaddas, A. Hat für Vitamin E Hinweise auf eine Cisplatin-induzierte Toxizität. J. Biochem. Mol. Toxicol. 2019 , 33 , e22349. [ Google Scholar ] [ CrossRef ]
50. Nakashima-Kamimura, N.; Mori, T.; Ohsawa, I.; Asoh, S.; Ohta, S. Molekularer Wasserstoff lindert die durch ein Krebsmedikament Cisplatin induzierte Nephrotoxizität, ohne die Antitumoraktivität bei Mäusen zu beeinträchtigen. Krebs-Chemother. Pharm. 2009 , 64 , 753–761. [ Google Scholar ] [ CrossRef ] [ PubMed ]
51. Kang, KM; Kang, YN; Choi, IB; Kerl.; Kawamura, T.; Toyoda, Y.; Nakao, A. Auswirkungen des Trinkens von wasserstoffreichem Wasser auf die Lebensqualität von Patienten, die wegen Lebertumoren mit Strahlentherapie behandelt werden. Med. Gas. Res. 2011 , 1 , 11. [ Google Scholar ] [ CrossRef ][ Grüne Version ]
52. Rochette, L.; Guenancia, C.; Gudjoncik, A.; Hachet, O.; Zeller, M.; Cottin, Y.; Vergely, C. Anthracycline/Trastuzumab: Neue Aspekte der Kardiotoxizität und molekularer Mechanismen. Trends Pharm. Wissenschaft. 2015 , 36 , 326–348. [ Google Scholar ] [ CrossRef ]
53. Gao, Y.; Yang, H.; Fan, Y.; Kleine.; Fang, J.; Yang, W. Wasserstoffreiche Kochsalzlösung mildert Herz- und Leberschäden im Doxorubicin-Rattenmodell durch Hemmung von Entzündungen und Apoptose. Mediat. Entzündung. 2016 , 2016 , 1320365. [ Google Scholar ] [ CrossRef ]
54. Lathia, J.; Liu, H.; Matei, D. Die klinische Wirkung von Krebsstammzellen. Onkologie 2020 , 25 , 123–131. [ Google Scholar ] [ CrossRef ][ Grüne Version ]
55. Kawai, D.; Takaki, A.; Nakatsuka, A.; Wada, J.; Tamaki, N.; Yasunaka, T.; Koike, K.; Tsuzaki, R.; Matsumoto, K.; Miyake, Y.; et al. Wasserstoffreiches Wasser verhindert das Fortschreiten der nichtalkoholischen Steatohepatitis und der damit einhergehenden Hepatokarzinogenese bei Mäusen. Hepatology 2012 , 56 , 912–921. [ Google Scholar ] [ CrossRef ]
56. Liu, MEIN; Xie, F.; Zhang, Y.; Wang, TT; Ma, SN; Zhao, PX; Zhang, X.; Lebaron, TW; Yan, XL; Ma, XM Molekularer Wasserstoff unterdrückt das Wachstum von Glioblastomen, indem er die stammähnliche Zelldifferenzierung von Gliomen induziert. Stammzellres. 2019 , 10 , 145. [ Google Scholar ] [ CrossRef ] [ PubMed ][ Grüne Version ]
57. Chen, J.; Mu, F.; Lu, T.; Du, D.; Xu, K. Hirnmetastasen verschwinden bei nicht-kleinzelligem Lungenkrebs vollständig durch Inhalation von Wasserstoffgas: Ein Fallbericht. Oncotargets Ther. 2019 , 12 , 11145–11151. [ Google Scholar ] [ CrossRef ] [ PubMed ][ Grüne Version ]
58. Harguindey, S.; Polo Orozco, J.; Alfarouk, KO; Devesa, J. Wasserstoffionendynamik von Krebs und ein neuer molekularer, biochemischer und metabolischer Ansatz zur Ätiopathogenese und Behandlung von Hirntumoren. Int. J. Mol. Wissenschaft. 2019 , 20 , 4278. [ Google Scholar ] [ CrossRef ][ Grüne Version ]
59. Tyrrell, RM; Reeve, VE Möglicher Schutz der Haut durch akute UVA-Bestrahlung – von Zell- bis Tiermodellen. Prog. Biophys. Mol. Biol. 2006 , 92 , 86–91. [ Google Scholar ] [ CrossRef ]
60. Shin, MH; Park, R.; Nojima, H.; Kim, HC; Kim, YK; Chung, JH Atomarer Wasserstoff, umgeben von Wassermolekülen, H(H2O)m, moduliert in vivo die basale und UV-induzierte Genexpression in der menschlichen Haut. PLoS ONE 2013 , 8 , e61696. [ Google Scholar ] [ CrossRef ][ Grüne Version ]
61. Kato, S.; Saitoh, Y.; Iwai, K.; Miwa, N. Wasserstoffreiches elektrolysiertes warmes Wasser unterdrückt die Faltenbildung vor UVA-Strahlen, zusammen mit der Produktion von Typ-I-Kollagen und der Verringerung von oxidativem Stress in Fibroblasten sowie der Vorbeugung von Zellverletzungen in Keratinozyten. J. Photochem. Photobiol. B 2012 , 106 , 24–33. [ Google Scholar ] [ CrossRef ]
62. Yang, Y.; Liu, PY; Bao, W.; Chen, SJ; Wu, FS; Zhu, PY Wasserstoff hemmt das Wachstum von Endometriumkrebs über einen ROS/NLRP3/Caspase-1/GSDMD-vermittelten pyroptotischen Weg. BMC Cancer 2020 , 20 , 28. [ Google Scholar ] [ CrossRef ]
63. Galadari, S.; Rahman, A.; Pallichankandy, S.; Thayyullathil, F. Reaktive Sauerstoffspezies und Krebsparadoxon: Fördern oder unterdrücken? Freies Radikal. Biol. Med. 2017 , 104 , 144–164. [ Google Scholar ] [ CrossRef ]
64. Yun, CW; Lee, SH Die Rolle der Autophagie bei Krebs. Int. J. Mol. Wissenschaft. 2018 , 19 , 3466. [ Google Scholar ] [ CrossRef ][ Grüne Version ]
65. Zhang, Y.; Liu, Y.; Zhang, J. Gesättigte Wasserstoffsalzlösung mildert Endotoxin-induzierte Lungenfunktionsstörungen. J. Surg. Res. 2015 , 198 , 41–49. [ Google Scholar ] [ CrossRef ]
66. Zhang, Y.; Tan, S.; Xu, J.; Wang, T. Wasserstofftherapie bei Herz-Kreislauf- und Stoffwechselerkrankungen: Von der Bank zum Krankenbett. Zelle. Physiol. Biochem. Int. J. Exp. Zelle. Physiol. Biochem. Pharmakol. 2018 , 47 , 1–10. [ Google Scholar ] [ CrossRef ]
67. Ge, L.; Yang, M.; Yang, NN; Yin, XX; Song, WG Molekularer Wasserstoff: Ein präventives und therapeutisches medizinisches Gas für verschiedene Krankheiten. Oncotarget 2017 , 8 , 102653–102673. [ Google Scholar ] [ CrossRef ] [ PubMed ][ Grüne Version ]
68. Ishibashi, T. Therapeutische Wirksamkeit von molekularem Wasserstoff: Eine neue mechanistische Erkenntnis. Curr. Pharm. Des. 2019 , 25 , 946–955. [ Google Scholar ] [ CrossRef ] [ PubMed ]
69. Nicolson, G.; de Mattos, G.; Settineri, R.; Costa, C.; Ellithorpe, R.; Rosenblatt, S.; La Valle, J.; Jimenez, A.; Ohta, S. Klinische Auswirkungen der Wasserstoffverabreichung: Von Tier- und Menschenkrankheiten bis zur Bewegungsmedizin. Int. J. Clin. Med. 2016 , 7 , 32–76. [ Google Scholar ] [ CrossRef ][ Grüne Version ]
Anmerkung des Herausgebers: MDPI bleibt in Bezug auf Zuständigkeitsansprüche in veröffentlichten Karten und institutionellen Zugehörigkeiten neutral.